题目内容
(8分)某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如右图所示装置。实验中他们取6.4g铜片与12mL18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余。
(1)为防止空气污染,请补画下图虚框中的实验装置,并注明所需要的试剂名称。
(2)写出铜跟浓硫酸反应的化学方程式:
。
(3)该小组认为铜片未完全溶解,则瓶中可能还有一定量的硫酸剩余,其原因是:
。
(4)为证明反应结束后的烧瓶中确有余酸,可选用下列药品中的 (填写字母序号): A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(8分)(1)(2分)左边导管长进短出,右边画有尾气吸收装置(1分),标出尾气吸收装置中的试剂为碱溶液(1分)
(2)(2分)Cu + 2H2SO4==== CuSO4 + SO2↑+ 2H2O
(3)(2分)反应过程中H2SO4被不断消耗,且生成的水逐渐增多(1分),使浓硫酸浓度变稀,至一定浓度时就不再与铜片反应(1分)。
(4)(2分)A D(错一个扣1分,扣完2分为止,本空不出现负分)
解析:

练习册系列答案
相关题目
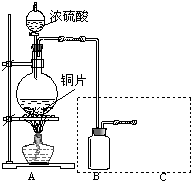 某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如图所示装置.实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余.
某小组同学为探究铜跟浓硫酸的反应情况,并收集一瓶反应产生的气体,设计了如图所示装置.实验中他们取6.4g铜片与12mL 18mol/L浓硫酸放在圆底烧瓶中加热,直到反应完毕仍发现烧瓶中有铜剩余.
