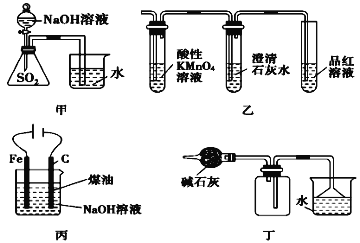
题目内容
【题目】一氧化碳是一种重要的化工原料。结合所学知识回答下列问题:
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=___。
(2)二氧化碳的回收利用是环保领域研究的热点课题。
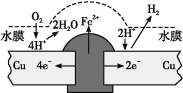
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___。
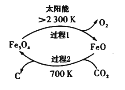
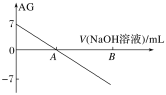
(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。
①图中Q点的含义是___,△H___0(填“>”或“<”)。
②某温度下,该反应达到平衡时c(COCl2)=0.80molL-1,c(Cl2)=0.20molL-1,则平衡体系中CO的体积分数为___(保留2位小数)。在该温度下,反应的平衡常数K=___。
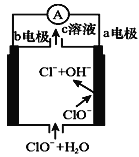
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:
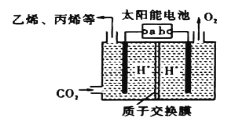
①b电极的名称是___。
②生成丙烯(C3H6)的电极反应式为___。
【答案】-90.1kJ·mol-1 CO2![]() C+O2 化学平衡状态 < 16.67% 20 正极 3CO2+18H++18e-→CH3CH=CH2+6H2O
C+O2 化学平衡状态 < 16.67% 20 正极 3CO2+18H++18e-→CH3CH=CH2+6H2O
【解析】
(1)根据盖斯定律计算;
(2)根据图像可知,反应物为二氧化碳,生成物为炭黑和氧气;
(3)根据图像可知,升高温度,正逆反应速率均增大,且逆反应速率增大的程度大于正反应速率,则升高温度,平衡逆向移动,逆向反应为吸热,则正反应为放热反应。
(4)①根据图知,氧的化合价由-2变为0价,失电子,则生成氧气的电极是阳极,则连接阳极的电源电极为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水。
(1)根据盖斯定律可知,①+②可得CO(g)+2H2(g)![]() CH3OH(g),则△H1=△H2+△H3=-90.1kJ·mol-1;
CH3OH(g),则△H1=△H2+△H3=-90.1kJ·mol-1;
(2)根据图像可知,反应物为二氧化碳,生成物为炭黑和氧气,则方程式为CO2![]() C+O2;
C+O2;
(3)根据图像可知,升高温度,正逆反应速率均增大,且逆反应速率增大的程度大于正反应速率,则升高温度,平衡逆向移动,逆向反应为吸热,则正反应为放热反应。
①根据图像可知在Q点之前为建立平衡的过程,而Q点之后为平衡移动的过程,且随着温度的升高平衡逆向移动,Q点为化学平衡状态;正反应为放热反应,则△H<0;
②初始时,充入等物质的量的Cl2、CO,根据Cl2(g)+CO(g)=COCl2(g),平衡时,c(Cl2)=c(CO)=0.20molL-1,平衡体系中CO的体积分数=![]() ×100%=16.67%;K=
×100%=16.67%;K=![]() =20;
=20;
(4)①根据图知,氧的化合价由-2变为0价,失电子,则生成氧气的电极是阳极,则连接阳极的电源电极为正极,所以b为正极;
②阴极上二氧化碳得电子和氢离子反应生成丙烯和水,电极反应式为3CO2+18H++18e-→CH3CH=CH2+6H2O。

【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11