题目内容
|
醋酸、甲醛的化学式依次为C2H4O2,CH2O,下列关于它们的说法中正确的是 | |
A. |
以任意比混和两种化合物并溶解于水,所得混和液中H、O元素质量比无法确定 |
B. |
以任意比混和两种化合物并溶解于水,所得混和液中H、O元素质量比是定值 |
C. |
以任意比混和两种化合物,完全燃烧产生的二氧化碳与水的质量比为22∶9 |
D. |
以任意比混和两种化合物,完全燃烧产生的二氧化碳与水的质量比无法确定 |
答案:BC

练习册系列答案
相关题目

 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3 如图中A、B、C、D是同周期或同主族的相邻元素:
如图中A、B、C、D是同周期或同主族的相邻元素: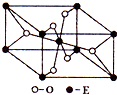 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.