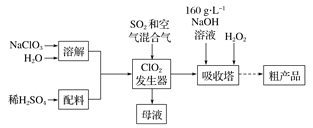
题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO![]()
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-
A.②④⑥ B.②⑥ C.② D.①③⑤
【答案】C
【解析】
试题分析:① NaAlO2溶液与H+反应生成铝离子,故①错误;②pH=11的溶液呈碱性:CO32-、Na+、AlO2-、NO3-、S2-、SO32-可以共存,②正确;③水电离的H+浓度为10-12mol·L-1的溶液,呈酸性或碱性,若呈酸性: CO32-、SO32-不能存在,③错误;④加入Mg能放出H2的溶液呈酸性,硝酸与镁反应不能生成氢气,不能含有NO3-,④错误;⑤使甲基橙变黄的溶液呈碱性:Fe2+不能存在,⑤错误;⑥中性溶液中:Fe3+不能存在,⑥错误;故选C。

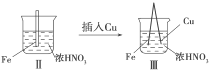
【题目】在通风厨中进行下列实验:下列说法不正确的是( )
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
A. Ⅰ中气体由无色变为红棕色的化学方程式:2NO+O2===2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中的现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中的现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化