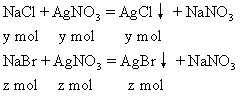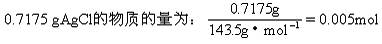题目内容
在含有NaCl和NaBr的混合液中,加入0.1mol/L的AgNO3溶液250mL,得到沉淀3.315g,过滤,向滤液中加入过量的盐酸,又得到沉淀0.7175g。求原混合液中NaCl和NaBr的质量各是多少?
答案:
解析:
提示:
解析:
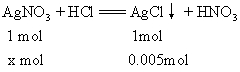
x=0.005mol n(AgNO3)=0.1mol/L×0.25L=0.025mol 与NaCl、NaBr反应的AgNO3物质的量为: 0.025mol-0.005mol=0.02mol 设原混合物中NaCl物质的量为y,NaBr物质的量为z。
解得:y=0.01(mol) z=0.01(mol) NaCl质量为:0.01mol×58.5g/mol=0.585g NaBr质量为:0.01mol×103g/mol=1.03g
|
提示:
| 本题涉及三个化学反应:NaCl跟AgNO3、NaBr跟AgNO3和HCl跟AgNO3的反应。要准确掌握这三个反应的关系。NaCl、NaBr与AgNO3的反应同时发生,生成的沉淀3.315g,包括AgCl和AgBr两种物质;0.1mol/LAgNO3溶液250mL中的AgNO3在上述两个反应中均过量,过滤后向滤液中加HCl,是使过量AgNO3完全沉淀(生成AgCl)。因此,本题可采取逆向推算的方法解答。基本思路是:
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目