��Ŀ����
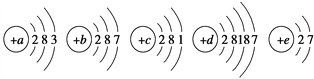
����Ŀ����֪���ֶ�����Ԫ�������ڱ��е����λ����ͼ��ʾ��
(1)��������Ԫ�ؽ�������ǿ��Ԫ��Ϊ_______����Ԫ�ط��ţ���c��e��Ԫ���γɵ����ӻ�����c2e�ĵ���ʽΪ___________��
(2)c��d��e����Ԫ�صļ������У��뾶��С����________����Ԫ�ط��ű�ʾ����
(3)b��e��Ԫ�طֱ���a�γɵ������̬��������ȶ��ԵĹ�ϵΪ____________���û�ѧʽ��ʾ����
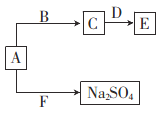
(4)��֪A��B��C��D��E��F���ֻ������������Ԫ���еļ�����ɡ�����֮��Ĺ�ϵ��ͼ��ʾ��AΪ����ɫ���壬B�dz���Һ�壬D�����������F�������������Ҫ���塣
��д������E�Ļ�ѧʽ��_________��
��д��A��F��Ӧ�Ļ�ѧ����ʽ��_____________________��
���𰸡� Na ![]() Al3+ H2O>H2S����H2S<H2O�� NaAlO2 Na2O2+SO2 =Na2SO4
Al3+ H2O>H2S����H2S<H2O�� NaAlO2 Na2O2+SO2 =Na2SO4
�����������Ԫ�����ڱ��Ľṹ��֪��aΪHԪ�ء�bΪOԪ�ء�cΪNaԪ�ء�dΪAlԪ�ء�eΪSԪ�أ�
(1)��������Ԫ�ؽ�������ǿ��Ԫ��ΪNa��c��e��Ԫ���γɵ����ӻ�����Na2SΪ���ӻ���������ʽΪ![]() ��
��
(2)S2-��Na+��Al3+��һ�����Ӳ㣬���Ӱ뾶���Na+��Al3+���Ӻ�������Ų���ͬ���˵����Խ�����Ӱ뾶ԽС��������Ԫ�صļ������У��뾶��С����Al3+��
(3)O�ķǽ����Ա�Sǿ����H2O���ȶ��Ա�H2Sǿ�����ȶ���H2O>H2S����H2S<H2O����
(4)AΪ����ɫ���壬��AΪNa2O2��B�dz���Һ�壬��BΪH2O��D�������������DΪAl2O3��F�������������Ҫ���壬��FΪSO2��
������������ˮ��Ӧ����NaOH��NaOH�ܽ�Al2O3���ɵ�EΪNaAlO2 ��
��Na2O2��SO2��Ӧ����Na2SO4�Ļ�ѧ����ʽΪNa2O2+SO2 =Na2SO4��