题目内容
16.4g NaOH和NaHCO3的固体混合物投入150ml 2.0mol·L-1的盐酸中恰好完全反应,不再产生气泡,则所得溶液中溶质的物质的量为多少
- A.2.0mol·L-1
- B.0.41 mol
- C.0.30 mol
- D.无法计算
C
试题分析:NaOH和NaHCO3与盐酸的反应方程式为 、
、 根据反应方程式可知,最后所得溶质为
根据反应方程式可知,最后所得溶质为 ,即求出
,即求出 的物质的量即为溶液中溶质的物质的量,可根据方程式求出
的物质的量即为溶液中溶质的物质的量,可根据方程式求出 的物质的量150ml ×2.0mol·L-1×10-3=0.3mol所得溶液中溶质的物质的量为0.30 mol。
的物质的量150ml ×2.0mol·L-1×10-3=0.3mol所得溶液中溶质的物质的量为0.30 mol。
考点:酸碱反应和强酸与酸式盐的反应
点评:本题考查酸碱反应和强酸与酸式盐的反应,考查根据化学反应方程式对溶液中物质的定量计算。
试题分析:NaOH和NaHCO3与盐酸的反应方程式为
 、
、 根据反应方程式可知,最后所得溶质为
根据反应方程式可知,最后所得溶质为 ,即求出
,即求出 的物质的量即为溶液中溶质的物质的量,可根据方程式求出
的物质的量即为溶液中溶质的物质的量,可根据方程式求出 的物质的量150ml ×2.0mol·L-1×10-3=0.3mol所得溶液中溶质的物质的量为0.30 mol。
的物质的量150ml ×2.0mol·L-1×10-3=0.3mol所得溶液中溶质的物质的量为0.30 mol。考点:酸碱反应和强酸与酸式盐的反应
点评:本题考查酸碱反应和强酸与酸式盐的反应,考查根据化学反应方程式对溶液中物质的定量计算。

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
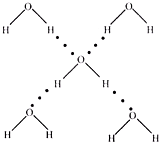 NA代表阿伏伽德罗常数值,下列说法正确的是( )
NA代表阿伏伽德罗常数值,下列说法正确的是( )