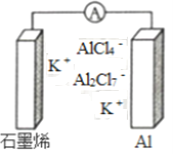
题目内容
【题目】将2. 80 g部分被氧化成氧化镁的镁条完全溶于50. 0 mL硫酸溶液后,滴加2. 00 mol·Lˉ1氢氧化钠溶液,恰好完全沉淀时用去200. 0 mL。将所得的沉淀灼烧、冷却后称量得固体质量为4. 40 g。
请计算:
(1)质量为4. 40 g的固体是____________(填化学式)。
(2)镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=____________。
(3)在与50. 0 mL硫酸溶液反应前被氧化的镁的质量是_____________g。
(4)上述硫酸的物质的量浓度c(H2SO4)=_____________mol·Lˉ1。
【答案】MgO 1︰10 0. 24 4. 00
【解析】
将2. 80 g部分被氧化成氧化镁的镁条完全溶于50. 0 mL硫酸溶液后,溶液中存在硫酸镁和可能剩余的硫酸,滴加2. 00 mol·Lˉ1氢氧化钠溶液,氢氧化钠首先与可能剩余的硫酸反应,再与硫酸镁反应生成氢氧化镁沉淀,将所得的沉淀灼烧、氢氧化镁分解生成氧化镁,冷却后称量得固体质量为4. 40 g,为氧化镁,可以计算出镁元素的物质的量,从而确定消耗的氢氧化钠的量,进一步判断是否有硫酸剩余,结合反应方程式和溶液的组成分析解答。
(1)镁和氧化镁与盐酸反应后生成氯化镁,氯化镁与氢氧化钠反应生成氢氧化镁沉淀,灼烧氢氧化镁,氢氧化镁分解生成氧化镁,因此4. 40 g的固体是氧化镁,故答案为:MgO;
(2)设镁条中含有镁和氧化镁的物质的量分别为x、y。则有①24g/mol×x+40g/mol×y=2.80g;4. 40 g氧化镁的物质的量为![]() =0.11mol;即②x+y=0.11mol,联立①②为方程组解得:x=0.1mol,y=0.01mol,镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=0.01mol︰0.1mol= 1︰10,故答案为:1︰10;
=0.11mol;即②x+y=0.11mol,联立①②为方程组解得:x=0.1mol,y=0.01mol,镁条中氧化镁和镁的物质的量之比n(MgO)︰n(Mg)=0.01mol︰0.1mol= 1︰10,故答案为:1︰10;
(3)0.01mol氧化镁中镁的物质的量为0.01mol,质量为0.24g,即在与50. 0 mL硫酸溶液反应前被氧化的镁的质量为0.24g,故答案为:0.24;
(4)反应后溶液中的镁离子与氢氧化钠反应生成氢氧化镁沉淀消耗的氢氧化钠为2. 00 mol·Lˉ1×0.2L=0.4mol,镁离子完全沉淀后溶液中含有的溶质为Na2SO4,则反应前硫酸的物质的量为氢氧化钠物质的量的一半,为0.2mol,因此原硫酸的物质的量浓度为![]() =4.00mol/L,故答案为:4. 00。
=4.00mol/L,故答案为:4. 00。

【题目】下列物质性质与用途的对应关系不正确的是
选项 | 性质 | 用途 |
A | 次氯酸有强氧化性 | 用作漂白剂 |
B | 氧化铝熔点很高 | 制造耐火坩埚 |
C | 硅有导电性 | 制造光导纤维 |
D | 硫酸有酸性 | 用于金属加工前的酸洗 |
A. A B. B C. C D. D