题目内容
6.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10LSO2就会放出2.5LCO2 |
分析 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2,其反应方程式为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,反应在S元素的化合价从-2价升高到+2价,S的化合价从+4价降低到+2价,以此解答该题.
解答 解:A.由反应方程式中S元素的化合价变化可知,硫元素既被氧化又被还原,故A正确;
B.2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2:1,故B错误;
C.反应中2Na2S转化为3Na2S2O3,转移8个电子,则生成1molNa2S2O3,转移$\frac{8}{3}$mol电子,故C错误;
D.根据方程式可知,每当4molSO2参与氧化还原反应就会放出1molCO2,则每10LSO2参与反应就会放出2.5LCO2,故D正确.
故选AD.
点评 本题考查了氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意根据反应物和生成物写出反应方程式,结合元素化合价的变化分析,题目难度中等.

练习册系列答案
相关题目
18.用下列实验装置进行相应实验,能达到实验目的是( )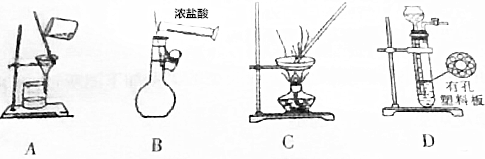

| A. | 用图a所示装置用除去淀粉溶液中的NaCl | |
| B. | 用图b所示装置配制100mL0.100mol•L-1稀盐酸 | |
| C. | 图c所示装置可用于从碘水中分离出I2 | |
| D. | 图d所示装置可用于CaCO3和稀盐酸制取少量的CO2气体 |
18.下列说法正确的是( )
| A. | 硫完全燃烧生成二氧化硫时,放出的热量为硫的标准燃烧热 | |
| B. | 在101kPa时,1mol碳燃烧所放出的热量为碳的标准燃烧热 | |
| C. | 在101kPa时,由2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,可知CO的标准燃烧热为283 kJ•mol-1 | |
| D. | 乙炔的标准燃烧热为1299.6 kJ•mol-1,则2CH2(g)+5O2(g)═4CO2(g)+2H2O(g)反应的△H=-2 599.2 kJ•mol-1 |
 工业上一般在密闭容器中采用下列反应合成甲醇:
工业上一般在密闭容器中采用下列反应合成甲醇: