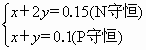题目内容
在标准状况下将3.36 L NH3通入含9.8 g磷酸的溶液中,可得到什么盐?各是多少克?
解析:
|
精析与解答:氨气与多元酸反应的产物较复杂,可能生成的是磷酸盐,也可能是磷酸二氢盐或磷酸氢盐或两种盐的混合物.究竟生成什么盐,主要取决于氨气与磷酸的物质的量之比.解题思路是写出相同反应物因量不同而可能出现的总反应情况,再求出题给的物质的量之比,与可能发生的反应的化学计量数进行对照而推出所存在的反应,最后由化学方程式建立关系式进行计算. NH3+H3PO4 2NH3+H3PO4 3NH3+H3PO4 n(NH3)=3.36 L÷22.4 L·mol-1=0.15 mol n(H3PO4)=9.8 g÷98 g·mol-1=0.1 mol 由此可知,①、②两反应均存在,产物为NH4H2PO4和(NH4)2HPO4. 解法一:关系式法 设发生反应①的氨气的物质的量为x mol,发生反应②的氨气的物质的量为y mol. NH3+H3PO4 1 1 1 x x x 2NH3+H3PO4 2 1 1 y 依题意得: (NH4)2HPO4的质量=132×0.05 g=6.6 g NH4H2PO4的质量=115×0.05 g=5.75 g. 解法二:原子守恒法 设生成NH4H2PO4 x mol,(NH4)2HPO4 y mol.依题意得: 解得: 生成(NH4)2HPO4的质量132×0.05 g=6.6 g 生成NH4H2PO4的质量=115×0.05 g=5.75 g 解法三:直接配平法 3NH3 + 2H3PO4 3 mol 2 mol 1 mol 1 mol 0.15 mol 0.1 mol 0.05 mol 0.05 mol 生成(NH4)2HPO4的质量=132×0.05 g=6.6 g 生成NH4H2PO4的质量=115×0.05 g=5.75 g 解法四:依反应顺序法 NH3 + H3PO4 0.1 mol 0.1 mol 0.1 mol 剩余n(NH3)=(0.15-0.1)mol=0.05 mol NH3 + NH4H2PO4 0.05 mol 0.05 mol 0.05 mol 生成(NH4)2HPO4的质量=132×0.05 g=6.6 g 生成NH4H2PO4的质量=115×(0.1-0.05)g=5.75 g 所以,产物中有磷酸氢铵和磷酸二氢铵,质量分别是6.6 g和5.75 g. 小结:解这一类题的关键有三方面,第一是判断物质过量;第二是判断产物中物质种类;第三是计算.以上几种解法中解法三和解法四较为简捷. |

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋
白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力。
(1)美蓝是亚硝酸盐中毒的有效解毒剂,下列说法正确的是 。(选填编号)
A.解毒时美蓝表现氧化性 B.中毒时亚硝酸盐发生氧化反应
C.解毒时高铁血红蛋白被还原 D.中毒过程中血红蛋白显氧化性
(2)NaNO2中钠离子核外有 种不同能级的电子,三种元素对应的简单离子半径由大到小的顺序为 。
(3)Na、N、O分别与H形成的简单化合物中熔点最高的是 (填化合物化学式),试解释原因 。
(4)已知NaNO2 能发生如下反应(未配平):NaNO2 + HI → NO + I2 + NaI + H2O当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(5)有人将26中反应产生的NO收集到一个固定容积的密闭容器中,并在常温下将其压缩到1.01×107 Pa,然后加热至50℃时,发现气体的压力迅速下降。当温度恢复到常温,压强降至略小于1.01×107 Pa的2/3时,就不再改变。已知此过程中有一种产物是N2O。请写出生成N2O的反应方程式: 。
解释最后的气体压强略小于1.01×107 Pa的2/3原因: 。
(6)某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②
NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 。(选填编号)
 ,解得:
,解得: