题目内容
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
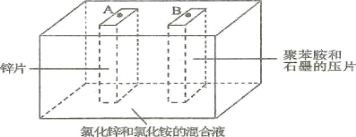
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
【答案】C
【解析】
由装置可知,Zn失去电子生成Zn2+(ZnCl2),由此可知,Zn片作电池负极,聚苯胺和石墨压片作电池正极,
A、放电时,Zn片做负极,发生的电极方程式为Zn -2e-=Zn2+,故A错误;
B、放电时,负极附近阳离子增加,根据电荷守恒可知,混合液中的Cl-向A移动,故B错误;
C、放电时,聚苯胺和石墨压片作电池正极,发生还原反应,故充电时,聚苯胺发生氧化反应,故C正确;
D、充电时,A端发生还原反应,应与电源负极相连,故D错误。

【题目】某实验小组制备草酸晶体(H2C2O4·2H2O)的实验装置如下:
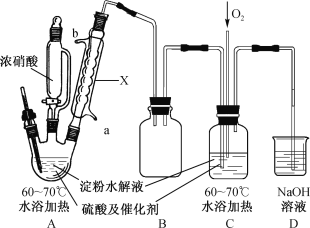
已知:I.草酸(H2C2O4)是二元弱酸,熔点101~102℃;
II.草酸的溶解度如下表所示:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g·(100g水)-1 | 9.5 | 14.3 | 21.2 | 31.4 | 46.0 | 84.5 |
III.在催化剂和硫酸存在下,用浓硝酸氧化淀粉水解液可制备草酸,发生的主要反应为:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。
回答下列问题:
(1)装置A中仪器X名称为___________,水从接口___________(填“a”或“b”)进入。
(2)装置B的作用是___________;设计装置C的目的是_________________________。
(3)反应C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O中,每生成1 mol H2C2O4转移电子的物质的量为____________。
(4)将装置A和C中反应液浓缩、静置结晶并过滤得粗草酸晶体,提纯H2C2O4·2H2O的方法是_________________________。
(5)探究草酸的性质:
①向Na2CO3溶液中滴加H2C2O4溶液,产生大量气体,说明草酸的酸性比碳酸________(填“强”或“弱”)。
②向NaClO溶液中加入过量H2C2O4溶液,有气泡产生,能解释这一现象的离子方程式为___。