题目内容
有
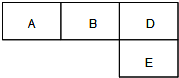
M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在右表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
(1)在A、B、D、E四种元素的最简单氢化物中,沸点最高的是
________(填化学式).M、D、E、N形成的简单离子的半径由大到小的关系是(写元素符号)________.
(2)A、B、D、M可组成多种18电子分子,请写出2种具有18电子的有机物的分子式(用元素符号表示)________、________.
(3)由A、D、N三种元素组成的无机物(相对分子质量106),其水溶液呈碱性,用离子方程式表示其原因________.
(4)元素B的氢化物与元素D单质在一定条件下发生置换反应,在该反应中氧化剂与还原剂的物质的量之比为________.
(5)由D、N形成的原子个数1∶1的化合物的电子式为________.其中包含的化学键类型有________和________.
(6)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________(填“a”或“b”)
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是:________(填“a”或“b”)

答案:
解析:
解析:
(1)H2O,S2->O2->Na+>H+
(2)CH3OH;CH3CH3
(3)CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
(4)3∶4
(5)过氧化钠电子式 ![]()
(6)b

练习册系列答案
相关题目
 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻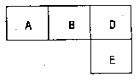 有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答:
有M、A、B、D、N、E五种短周期元素,原子序数依次增大.M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期原子半径最大的.A、B、D、E分别在表(周期表的一部分)占有相应的位置,它们的原子序数之和为37.试回答: