题目内容
8.下列离子方程式正确的是( )| A. | 向硫酸铝溶液加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| C. | 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | 向NaHCO3溶液中加入足量氢氧化钡溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |
分析 A.一水合氨为弱碱,一水合氨按不能拆开;
B.反应后溶液为中性时,氢离子与氢氧根离子的物质的量应该相等;
C.双氧水具有强氧化性,能够将亚铁离子氧化成铁离子;
D.氢氧化钡足量,反应后产物中不会存在碳酸根离子.
解答 解:A.向硫酸铝溶液加入过量氨水,反应生成硫酸铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性,氢氧化钡与硫酸氢钠的物质的量之比为1:2,正确的离子方程式为:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故B错误;
C.硫酸亚铁溶液与稀硫酸、双氧水混合,二者发生氧化还原反应,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,故C正确;
D.向NaHCO3溶液中加入足量氢氧化钡溶液混合,反应生成碳酸钡沉淀、氢氧化钠和水,正确的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
18.据北京市园林局的不完全统计,城八区范围内共有11000余株行道树、149万余株绿篱、色块等灌木、近20万平方米草坪遭受严重盐害或死亡,直接影响了2008年“绿色奥运”开展.我国今年遭遇了特大雪灾,我国科学家用氯化钙、尿素、葡萄糖酸钠等为原料成功研制出一种新型复合融雪剂.下列说法正确的是( )
| A. | 葡萄糖酸钠是非电解质 | |
| B. | 传统的氯化钠融雪剂由于价格偏高而减少使用 | |
| C. | 大量使用传统的氯化钠融雪剂会造成植物枯死 | |
| D. | 传统的氯化钠融雪剂通过升高水的凝固点实现雪融化 |
19.下列各组溶液只通过相互滴加不能鉴别出来的是( )
| A. | NaAlO2溶液和盐酸 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | NaOH溶液和浓AlCl3溶液 | D. | 稀硫酸和碳酸钠溶液 |
16.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0mol•L-1的Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.a g H2SO4中含有b个氢原子,则阿伏加德罗常数为( )
| A. | $\frac{49a}{b}$ mol-1 | B. | $\frac{49b}{a}$ mol-1 | C. | $\frac{98a}{b}$ mol-1 | D. | $\frac{98b}{a}$ mol-1 |
13.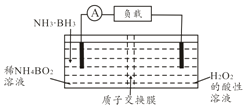 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
 直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )
直接氨硼烷(NH3•BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3•BH3+3H2O2═NH4BO2+4H2O.下列说法正确的是( )| A. | 左侧电极发生还原反应 | |
| B. | 电池工作时,H+通过质子交换膜向负极移动 | |
| C. | 正极的电极反应式为2H++2e-=H2↑ | |
| D. | 消耗3.1g氨硼烷,理论上转移0.6mol电子 |
20.下列物质能和水发生化合反应的是( )
| A. | Al2O3 | B. | Na2O2 | C. | MgO | D. | NO2 |
