题目内容
18.已知 (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是( )
(p)的分子式均为C6H6,下列说法正确的是( )| A. | b的同分异构体只有d和p两种 | |
| B. | b、d、p的二氯代物均只有三种 | |
| C. | b、d、p均可与酸性高锰酸钾溶液反应 | |
| D. | b、d、p中只有b的所有原子处于同一平面 |
分析 A.b为苯,对应的同分异构体可为环状烃,也可为链状烃;
B.d对应的二氯代物大于3种;
C.b、p与高锰酸钾不反应;
D.d、p都含有饱和碳原子,具有甲烷的结构特点.
解答 解:A.b为苯,对应的同分异构体可为环状烃,也可为链状烃,如HC≡C-CH=CH-CH=CH2,则同分异构体不仅仅d和p两种,故A错误;
B.d编号如图 ,对应的二氯代物中,两个氯原子可分别位于1、2,1、3,1、4,2、3等位置,故B错误;
,对应的二氯代物中,两个氯原子可分别位于1、2,1、3,1、4,2、3等位置,故B错误;
C.p为饱和烃,与高锰酸钾不反应,且b也不反应,故C错误;
D.d、p都含有饱和碳原子,具有甲烷的结构特点,则d、p所有原子不可能处于同一平面,只有b为平面形结构,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把握有机物同分异构体的判断以及空间构型的判断,难度不大.

练习册系列答案
相关题目
9.下列关于有机化合物的说法不正确的是( )
| A. | 可以用新制的氢氧化铜悬浊液(可加热)鉴别乙醇、乙酸和葡萄糖 | |
| B. | 苹果酸的结构简式为HOOCCH(OH)CH2COOH,则该物质可发生氧化、酯化、缩聚反应 | |
| C. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物共有24种 | |
| D. | 高分子化合物  的单体是CH2=CH2和C2H5COOH 的单体是CH2=CH2和C2H5COOH |
10.实验室用KClO3在MnO2催化下受热分解制取少量O2,并回收KCl,下列装置不能达实验目的是( )
| A. |  制取氧气 | B. |  收集氧气 | C. |  分离出MnO2 | D. |  蒸发结晶得KCl |
6.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 在标准状况下,VL气态烯烃(CnH2n)含碳碳双键的数目为$\frac{V}{22.4}$ NA | |
| B. | 在8.4 g NaHCO3晶体中,所含离子数目为0.3NA | |
| C. | 5.6g铁粉与稀硝酸反应,转移的电子数是0.3 NA | |
| D. | 在沸水中滴加含0.1 molFe3+的FeCl3饱和溶液,得到的Fe(OH)3胶粒数为0.1NA |
13.下列说法错误的是( )
| A. | 糖类化合物也可称为碳水化合物 | |
| B. | 维生素D可促进人体对钙的吸收 | |
| C. | 蛋白质是仅由碳、氢、氧元素组成的物质 | |
| D. | 硒是人体必需的微量元素,但不宜摄入过多 |
3.2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )| A. | Ts是第七周期第ⅦA族元素 | |
| B. | Ts的同位素原子具有相同的电子数 | |
| C. | Ts在同族元素中非金属性最弱 | |
| D. | 中子数为176的Ts核素符号是${\;}_{117}^{176}$Ts |
10.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1.
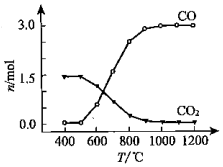
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H>0(填“>”“<”或“=”),判断依据:温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应.
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是饱和食盐水、氯化亚铁溶液.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有TiO2、C.
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4.示意图如下:
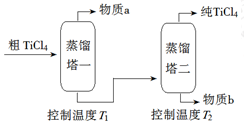
物质a是SiCl4,T2应控制在136℃左右.

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ•mol-1
2C(s)+O2(g)=2CO(g)△H2=-220.9kJ•mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)△H=-45.5kJ•mol-1.
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H>0(填“>”“<”或“=”),判断依据:温度越高,CO的物质的量越多而CO2的物质的量少,说明CO2生成CO的反应是吸热反应.

③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是饱和食盐水、氯化亚铁溶液.
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有TiO2、C.
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4.示意图如下:

物质a是SiCl4,T2应控制在136℃左右.



 .
. .
. ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是
;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是 .
. 路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).