题目内容
(10分)运用相关原理,回答下列各小题:
(1)常温下,PH=5的溶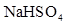 液中水的电离程度 PH=9的
液中水的电离程度 PH=9的 中水的电离程度。(填“>”、“=”或“<”)
中水的电离程度。(填“>”、“=”或“<”)
(2)等体积等物质的量浓度的 与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则
 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
(3)将分别含有 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:①若
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:①若 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定不存在的离子有 。
【答案】
(1)= (1分)
(2)NH4++H2O NH3·H2O+H+
(2分)
NH3·H2O+H+
(2分)
=(1分) PH>7(1分)
(3)① (1分);
(1分); (2分);
(2分);
② (2分)
(2分)
【解析】
试题分析:(1)常温下,PH=5的溶 液中水的电离的OH-为10-9mol/L,PH=9
液中水的电离的OH-为10-9mol/L,PH=9
 中水电离出的H+为10-9mol/L,两者电离程度相同。
中水电离出的H+为10-9mol/L,两者电离程度相同。
(2)溶液呈酸性是由于NH4+的水解,根据电荷守恒可得 =
= 
(3)将 的混合液调节至强酸性,若
的混合液调节至强酸性,若 离子有剩余,
离子有剩余, 已经没有剩余,则还存在的是
已经没有剩余,则还存在的是 ,所得混合液呈紫色,说明存在MnO4-,其具有氧化性,
,所得混合液呈紫色,说明存在MnO4-,其具有氧化性, 不能存在。
不能存在。
考点:弱电解质的电离和水解、离子共存、氧化还原反应
点评:电离程度就是分子在水中的电离的百分比;通常强酸弱碱盐由于存在水解,而使溶液呈酸性。

练习册系列答案
相关题目
 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则 在水中的电离方程式为
在水中的电离方程式为
 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”) 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后: 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是