题目内容
2SO2+O2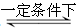 2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
2SO3是制造硫酸的重要反应。下列关于该反应的说法正确的是
| A.使用催化剂不影响反应速率 |
| B.降低体系温度能加快反应速率 |
| C.增加O2的浓度能加快反应速率 |
| D.一定条件下达到反应限度时SO2全部转化为SO3 |
C
解析试题分析:该反应为可逆反应,反应物不可能完全转化,一般来说,增大浓度、升高温度或加入催化剂,可增大反应速率,以此解答该题。A、使用催化剂,反应速率增大,故A不正确;B、降低温度,活化分子百分数减小,反应速率减小,故B错误;C、增加O2的浓度,单位体积活化分子数目增多,则反应速率增大,故C正确;D、可逆反应反应物不可能完全转化,故D错误,故选C。
考点:考查化学反应速率的影响

练习册系列答案
相关题目
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体。下列措施对改变该反应的速率几乎没有影响的是( )
| A.用相同浓度但温度较高的盐酸代替常温下的盐酸 |
| B.增大反应体系的压强或减小反应体系的压强 |
| C.改用相同质量但为粉末状态的碳酸钙代替块状碳酸钙 |
| D.改用与原盐酸含有相同H+浓度的稀硫酸 |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
| A.反应开始2分钟内平均反应速率最大 |
| B.反应4分钟后平均反应速率最小 |
| C.反应开始4分钟内温度对反应速率的影响比浓度大 |
| D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小 |
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| | 改变条件 | 新平衡与原平衡比较 |
| A | 增大压强 | N2的浓度一定变小 |
| B | 升高温度 | N2的转化率变小 |
| C | 充入一定量H2 | H2的转化率不变,N2的转化率变大 |
| D | 使用适当催化剂 | NH3的体积分数增大 |
反应C(s)+H2O(g) CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
CO(g)+ H2(g)在一容积可变的密闭容器中进行。下列条件的改变对其反应速率几乎无影响的是
| A.压缩容器体积,增大体系压强 |
| B.加入适当的催化剂 |
| C.保持压强不变,充入惰性气体使容器容积增大 |
| D.保持容器容积不变,充入惰性气体使体系压强增大 |
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,下列说法错误的是
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
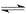 2Z,其平衡常数为1600
2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g)
 Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
 2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法: