题目内容
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列实验现象和结论一 致且正确的是
A. 加入有色布条,褪色,说明溶液中有 Cl2 存在
B. 溶液呈现黄绿色,且有刺激性气味,说明有 Cl2 存在
C. 先加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明有 Cl-存在
D. 新制氯水放置数天后酸性将减弱
【答案】B
【解析】
氯水中存在Cl2+H2O![]() H++Cl-+HClO的反应,该反应是可逆反应,所以氯水中含有的微粒有:三分子:Cl2、HClO、H2O;四离子:H+、Cl-、ClO-、OH-。因而氯水可以表现不同性质:
H++Cl-+HClO的反应,该反应是可逆反应,所以氯水中含有的微粒有:三分子:Cl2、HClO、H2O;四离子:H+、Cl-、ClO-、OH-。因而氯水可以表现不同性质:
A、能使有色布条褪色的是次氯酸;
B、呈黄绿色且有刺激性气味的是氯气;
C、盐酸能干扰氯离子的检验;
D、氯水放置数天后,次氯酸分解生成盐酸,酸性增强。
A、次氯酸有强氧化性能使有色布条褪色,向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有HClO存在,故A错误;
B、氯气是黄绿色气体,且有刺激性气味,如果氯水溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在,所以B选项是正确的;
C、盐酸中含有氯离子,向氯水中加入盐酸后再加入硝酸银溶液生成氯化银白色沉淀,不能说明氯水中含有氯离子,故C错误;
D、氯水放置数天后,次氯酸分解生成盐酸,酸性增强,pH将变小,故D错误。
所以B选项是正确的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
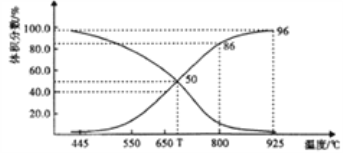
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。

