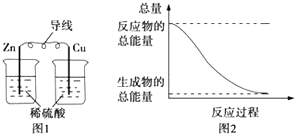
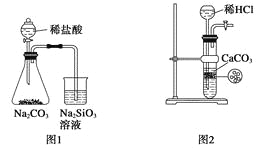
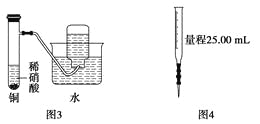
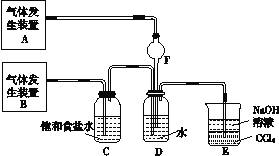
��Ŀ����
����Ŀ�������£���0.25mol��L��1��������Һ����μ������ʵ���Ũ����ͬ������������Һ�����ɳ����������������������Һ�������ϵ��ͼ��ʾ��a��b��c��d�ֱ��ʾʵ�鲻ͬʱ�̵���Һ�������й�˵������ȷ���ǣ�������
A. ������Һ�����Ϊ25 m L
B. bʱ����Һ��SO![]() ��Ũ��ԼΪ0.125 mol��L��1
��Ũ��ԼΪ0.125 mol��L��1
C. dʱ����Һ��pHΪ12
D. ��Һ�ĵ���������c��d��b��a
���𰸡�D
��������A��������������������кͷ�Ӧ����������������Һ�ļ��룬��Һ�������ӵ�Ũ�����ͣ���Һ��PHֵ�������ﵽc��ʱ���������������ǡ�÷�Ӧ�������ᱵ��ˮ�������������ʵ���Ũ�Ⱥ�����������Һ���ʵ���Ũ����ȣ�����������Һ�����Ϊ20mL����A������
B��bʱ��������������ʵ���Ũ��Ϊ��0.25mol/L��20mL20mL+10mL=0.167mol/L����B����
C��d��Һ�ʼ��ԣ�c��OH-��=10mL��0.25mol/L��220mL+30mL=0.1mol/L��c��H+��=10-13��pH=13����C������
D��������������Һ�������ƶ����ӵ�Ũ���йأ�����Ũ��Խ��������Խǿ����������������Һ�ļ��룬��Һ����������Ӻ����������٣����ﵽc��ʱ���������������ǡ�÷�Ӧ�������ᱵ��ˮ����Һ�ĵ�������С�������μ�����������Һʱ�����������ǿ����Ե�ǿ����ʣ���Һ�������ƶ�������Ũ��������������ǿ�����Ե����������ȼ�С������d������Ũ��С��b�����Ե���������С˳����a��b��d��c����D��ȷ����ѡD��

����Ŀ��ijʵ��С���H2O2�ķֽ���������̽�����±��Ǹ�ʵ��С���о�Ӱ��H2O2�ֽ����ʵ�����ʱ
��¼��һ�����ݣ���10mL H2O2��ȡ150mL����״���£�O2�����ʱ�䣨s��
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
���������� | ��������Ӧ | ��������Ӧ | ��������Ӧ | ��������Ӧ |
�������� | 360 | 480 | t | 720 |
MnO2�������� | 10 | 25 | 60 | 120 |
��1���ٸ�ʵ��С������Ʒ���ʱ��������Ũ�ȡ��������ض�H2O2�ֽ����ʵ�Ӱ�죮
�������ض�H2O2�ֽ����ʵ�Ӱ��ֱ��ǣ�
���Ʋ�t��s���ķ�ΧΪ ��
��2�������йش�����˵������ȷ����������ţ�
A.���������뷴Ӧ����Ӧǰ����������ʺ�����������
B.�����ڻ�ѧ��Ӧǰ��ѧ���ʺ�����������
C.������ʹ����Ӧ�����ʷ�����Ӧ
D.�����ܸı仯ѧ��Ӧ����
E.�κλ�ѧ��Ӧ����Ҫ����
F.�������и߶ȵ�ѡ���ԣ���רһ�ԣ�
��3����������ͬ���ۼ�״̬��ͬ��MnO2�ֱ����15mL 5%��H2O2��Һ�У����ô����ǵ�ľ�����ԣ�������£�
����MnO2 | ������� | �۲��� | ��Ӧ�������ʱ�� |
��ĩ״ | ��ϲ��� | ���ҷ�Ӧ�������ǵ�ľ����ȼ | 3.5min |
��״ | ��Ӧ���������Ǻ�����ľ��δ��ȼ | 30min |
��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽ ��
��ʵ���������������Ĵ�Ч�����йأ�