题目内容
地壳中铝元素比铜元素含量高很多,但人们冶炼出铜比铝早很多年。合理的解释是
| A.铜矿较易还原,铝矿很难还原 |
| B.铜矿颜色较深,易发现;铝矿颜色较浅,不易发现 |
| C.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发 |
| D.铜比铝相对原子质量大 |
A
解析试题分析:由于金属性是铜弱于铝,而金属越活泼,其金属阳离子越难被还原,所以冶炼出铜比铝早很多年,因此A正确,其余选项均是错误的,答案选A。
考点:考查金属性质以及金属冶炼的判断

练习册系列答案
相关题目
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是
| A.加热Al2O3 | B.加热CaCO3 | C.电解熔融NaCl | D.氯化钠与铝粉高温共热 |
下列金属冶炼的反应原理,错误的是 ( )
A.2NaCl(熔融) 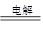 2 Na+Cl2↑ 2 Na+Cl2↑ | B.MgO+H2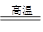 Mg+H2O Mg+H2O |
C.Fe2O3+3CO 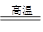 2Fe+3CO2 2Fe+3CO2 | D.2HgO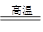 2Hg+O2↑ 2Hg+O2↑ |
下列有关海水综合利用的说法正确的是( )
| A.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| B.电解MgCl2饱和溶液,可制得金属镁 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制得金属钠 |
| D.从海带中提取碘单质的过程不涉及氧化还原反应 |
有关海洋中部分资源的利用(如图)的说法不正确的是
| A.工业上利用Cl2与澄清石灰水反应制取漂白粉 |
| B.用MgCl2·6H2O晶体制无水MgCl2,需在HCl气流中加热脱水 |
| C.SO2水溶液吸收Br2的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr |
| D.粗碘中混有少量HCl和IBr可加入KI进行升华提纯 |
粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素单质相似,都是较强的氧化剂,而且受热时ICl和IBr皆可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是( )。
| A.H2O | B.Zn | C.KI | D.KCl |
许多国家十分重视海水资源的综合利用,不需要化学变化就能从海水中获得的物质是( )。
| A.Cl2、Br2、I2 | B.Na、Mg、Al |
| C.食盐、淡水 | D.NaOH、H2 |
下列制备金属单质的方法或原理正确的是( )
| A.在高温条件下,用H2还原MgO制备单质Mg |
| B.在通电条件下,电解熔融Al2O3制备单质Al |
| C.在通电条件下,电解饱和食盐水制备单质Na |
| D.加强热,使CuO在高温条件下分解制备单质Cu |