��Ŀ����
�������գ�
��1���ڱ�״���£�448 mLij���������Ϊ0.64
 g�����������������Է�
g�����������������Է� ������Ϊ________��
������Ϊ________��
��2��ij�Ȼ������Ȼ��ƵĻ��Һ,��֪c(Fe3��)��0.2 mo l��L��1��c(Cl��)��1 mol��L��1����c(Na��)Ϊ ��
l��L��1��c(Cl��)��1 mol��L��1����c(Na��)Ϊ ��
��3��19gij���۽������Ȼ���RCl2�к���0��4mol��Cl-���ӣ���R�����ԭ������Ϊ ��
��4��V L Fe2(SO4)3��Һ�к�Fe3�� m g������Һ��SO42�������ʵ���Ũ��Ϊ mol��L��1��
��5�������������У�����1 L�ں�5 mol NH4Cl��1.6 mol KCl��2.4 mol K2SO4��ijӪ��Һ������KCl��NH4Cl��(NH4)2SO4���ƣ�����KCl��NH4Cl�����ʵ����ֱ�Ϊ _____________ �� ________ ��
��6����ͼ��ʾ���ֱ����ܱ������ڿ��ƶ����������߳������(��֪�������ռ���������ݻ���1/4)��H2��O2�Ļ�����壬�ڱ�״���£�����H2��O2�Ļ�������ȼ���������������ָ�ԭ�¶Ⱥ����һ�ͣ�������������롣��ԭ��H2��O2�����֮�ȿ���Ϊ ��

ú�������Ǹ�Ч����������ú̿����Ҫ;��֮һ��
��1����̿��ˮ������Ӧ�ǽ�����ú��Ϊ����ȼ�ϵķ�������֪��
�� C(s)+ O2 (g) = CO2 (g) ��H = -393.5 kJ��mol-1
�� CO(g) +  O2 (g) = CO2 (g) ��H = -283.0 kJ��mol-1
O2 (g) = CO2 (g) ��H = -283.0 kJ��mol-1
�� H2(g) +  O2 (g) = H2O (g) ��H = -241.8 kJ��mol-1
O2 (g) = H2O (g) ��H = -241.8 kJ��mol-1
��̼��ˮ������Ӧ����һ����̼���������Ȼ�ѧ����ʽ�� ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K���¶ȵ����߽� �����������С�����䡱����
��2��CO������H2O(g)��һ��������ӦCO(g) + H2O(g) CO2(g)+H2(g) ��H��0���ڼס������������ܱ������У���ʼʱ�����±����ݽ���Ͷ�ϣ���800��ʱ�ﵽƽ��״̬��K=1.0��
CO2(g)+H2(g) ��H��0���ڼס������������ܱ������У���ʼʱ�����±����ݽ���Ͷ�ϣ���800��ʱ�ﵽƽ��״̬��K=1.0��
H2O | CO | CO2 | H2 | |
�� n/ mol | 0.10 | 0.30 | 0.10 | 0.50 |
�� n/ mol | 0.20 | 0.20 | 0 | 0 |
��ʼʱ���������з�Ӧ�� �������Ӧ�����淴Ӧ����������У�ƽ��ʱ����������CO��ת����Ϊ ��
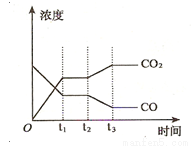
����ͼ��ʾ������Ӧ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯���������t2ʱ�̷����ı�����п��ܵ������� ��
��3����COΪȼ������ȼ�ϵ�أ���ص�����ͨ��O2��CO2������ͨ��CO�������������̼���ƣ�����ʱ������ӦʽΪ ����ʹ�øõ�ص������Al2O3��ȡ10.8g Al������������Ҫ���������Ϊ����״���£� L��


 CH3COO-+H+�����ڸ�ƽ�⣬����������ȷ����( )
CH3COO-+H+�����ڸ�ƽ�⣬����������ȷ����( )
 �£�5.6L CCl4���еķ�����Ϊ0.25NA
�£�5.6L CCl4���еķ�����Ϊ0.25NA ���������Ϊ11.2 L(���������ͬ�����²ⶨ)����õ���������Ļ�ѧʽΪ( )
���������Ϊ11.2 L(���������ͬ�����²ⶨ)����õ���������Ļ�ѧʽΪ( )