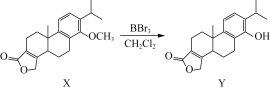
题目内容
【题目】按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是__。
(2)下列关于化学键的说法正确的是____。
① 含有金属元素的化合物一定是离子化合物
② 第IA族和第ⅦA族元素原子化合时,一定生成离子键
③ 由非金属元素形成的化合物一定不是离子化合物
④ 活泼金属与非金属化合时,能形成离子键
⑤ 离子键就是阴、阳离子间的相互引力
⑥离子化合物中可能含有非极性共价键
(3)写出下列物质的电子式:Mg(OH)2:____, N2:_______,NH4I:_______。
(4)用电子式表示下列化合物的形成过程:Na2S:_______;H2O:_______。
【答案】![]() ④⑥
④⑥ ![]()
![]()

![]()
![]()
【解析】
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子电子数比质子数多1个,为带1个单位负电荷的阴离子,核中有17个质子,则为![]() ;
;
(2)① 含有金属元素的化合物不一定是离子化合物,如AlCl3为共价化合物,①错误;
② 第IA族和第ⅦA族元素原子化合时,不一定生成离子键,如HCl,②错误;
③ 由非金属元素形成的化合物可能是离子化合物,如NH4Cl,③错误;
④ 活泼金属与非金属化合时,能形成离子键,如NaCl、KI等,④正确;
⑤ 离子键就是阴、阳离子间的相互作用,既有引力又有斥力,⑤错误;
⑥离子化合物中可能含有非极性共价键,如Na2O2,⑥正确;
故答案为:④⑥;
(3)Mg(OH)2:由Mg2+和OH-构成,电子式为![]() ;
;
N2:两个N原子间形成三对共用电子,电子式为![]() ;
;
NH4I:由NH4+和I-构成,电子式为 ;
;
(4)Na2S:![]() ;
;
H2O:![]() 。
。

【题目】现有三种可溶性物质A、B、C,其中有一种是碱,两种是盐,溶于水后电离产生的离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成一些实验。请根据实验的结果回答下列问题:
(1)A溶液与B溶液反应可生成气体X。根据上述六种离子之间的可能反应判断X的化学式为 ,A溶液与B溶液反应的离子方程式为 。
(2)气体X可以和C溶液反应生成沉淀D,沉淀D可与B溶液反应。则C的化学式为 ,B溶于水后的电离方程式为 。
(3)B溶液与C溶液反应生成不溶于稀硝酸的白色沉淀E。B溶液与C溶液反应至中性的离子方程式为 。
(4)D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为bL,则求算E在混合物中的质量分数的表达式为 。