��Ŀ����
����Ŀ���������̿����������������������·�Ӧ������ȡ�������̣�
4Mn(NO3)2��6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2��+40CH3COOH��
(1)��̬��ԭ�ӵļ۲�����Ų�ʽΪ______����̬Mn3+���е�δ�ɶԵ�������______��
(2) CH3COOH��̼ԭ�ӵ��ӻ���ʽΪ________��
(3) NO3-�Ŀռ乹����________����NO3-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽΪ__________(��дһ��)��
(4) CH3COOH����H2O������Ȼ��ܵ�ԭ����____________________��
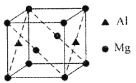
(5)ij��þ���Ͻ����Ϊ���Ʋ��ϣ��úϽ��ṹ��ͼ��ʾ�������ⳤΪanm���úϽ�Ļ�ѧʽΪ_______��������ÿ��þԭ����Χ�����������ԭ����ĿΪ_______���þ�����ܶ�Ϊ______g/cm3(����٤����������ֵ��NA��ʾ)��
���𰸡�3d54s2 4 sp3��sp2 ƽ�������� BF3��BCl3 CH3COOH��H2O��Ϊ���Է��ӣ��ҷ��Ӽ�����γ���� Mg2Al 4 ![]()
��������
(1)��Ϊ25��Ԫ�أ���Ϻ�������Ų��Ĺ�����д��̬��ԭ�ӵļ۲�����Ų�ʽ�����ݻ�̬Mn3+�ļ۲�����Ų�ʽ����Ϻ��ع����жϣ�
(2) ���ݼ۲���ӶԸ���=��������+�µ��ӶԸ������η���CH3COOH�м��ϵ�̼ԭ�Ӻ��Ȼ��ϵ�̼ԭ�ӵ��ӻ���ʽ��
(3) ���ݼ۲���ӶԸ���=��������+�µ��ӶԸ�������NO3һ�е�ԭ�ӵ��ӻ����ͣ����жϿռ乹�ͣ����ݵȵ���ԭ��������дNO3-�ĵȵ����壻
(4) CH3COOH��H2O��Ϊ���Է��ӣ��������������
(5) ���ݾ����ṹ���㾧���к��е�þԭ�Ӻ���ԭ����Ŀ��д�Ͻ�Ļ�ѧʽ���þ����У�þԭ��λ�ڶ����2��������ģ���ԭ��λ��2��������ģ������ж�ÿ��þԭ����Χ�����������ԭ����Ŀ�����ݾ����ⳤ���㾧������������ݾ����Ļ�ѧʽ���㾧�����������ٸ����ܶȵļ��㹫ʽ���㡣
(1)��Ϊ25��Ԫ�أ���̬��ԭ�ӵļ۲�����Ų�ʽΪ3d54s2����̬Mn3+�ļ۲�����Ų�ʽΪ3d4������4��δ�ɶԵ��ӣ��ʴ�Ϊ��3d54s2��4��
(2) CH3COOH�м��ϵ�̼ԭ�Ӻ���4��������û�йµ��Ӷԣ�����sp3�ӻ����Ȼ��ϵ�̼ԭ�Ӻ���3��������û�йµ��Ӷԣ�����sp2�ӻ����ʴ�Ϊ��sp3��sp2��
(3) NO3һ�е�ԭ�Ӽ۲���Ӷ���Ϊ3+![]() =3��Nԭ�ӹ�����ӻ�����Ϊsp2���ռ乹��Ϊƽ�������Σ�NO3-����4��ԭ�ӣ�5+6��3+1=24���۵��ӣ�SO3����4��ԭ�ӣ�6+6��3=24���۵��ӣ���NO3-�ǵȵ����壬BF3��COF2��Ҳ�����������Ϊ�ȵ����壬�ʴ�Ϊ��ƽ�������Σ�SO3��BF3��COF2�ȣ�
=3��Nԭ�ӹ�����ӻ�����Ϊsp2���ռ乹��Ϊƽ�������Σ�NO3-����4��ԭ�ӣ�5+6��3+1=24���۵��ӣ�SO3����4��ԭ�ӣ�6+6��3=24���۵��ӣ���NO3-�ǵȵ����壬BF3��COF2��Ҳ�����������Ϊ�ȵ����壬�ʴ�Ϊ��ƽ�������Σ�SO3��BF3��COF2�ȣ�
(4) CH3COOH��H2O��Ϊ���Է��ӣ��ҷ��Ӽ�����γ������ʹ��CH3COOH����H2O������Ȼ��ܣ��ʴ�Ϊ��CH3COOH��H2O��Ϊ���Է��ӣ��ҷ��Ӽ�����γ������
(5) ���ݾ����ṹ��֪�������к��е�þԭ����Ŀ=8��![]() +2��
+2��![]() =2����ԭ����Ŀ=2��
=2����ԭ����Ŀ=2��![]() =1���úϽ�Ļ�ѧʽΪMg2Al���ھ����У�þԭ��λ�ڶ����2��������ģ���ԭ��λ��2��������ģ�ÿ��þԭ����Χ�����������ԭ����ĿΪ4���������Ϊ��Խ��߳��ȵ�һ�룻�����ⳤΪanm�����������Ϊ(a��10-7)3cm3������������=
=1���úϽ�Ļ�ѧʽΪMg2Al���ھ����У�þԭ��λ�ڶ����2��������ģ���ԭ��λ��2��������ģ�ÿ��þԭ����Χ�����������ԭ����ĿΪ4���������Ϊ��Խ��߳��ȵ�һ�룻�����ⳤΪanm�����������Ϊ(a��10-7)3cm3������������=![]() g=
g=![]() g�������ܶ�=
g�������ܶ�= =
=![]() g/cm3���ʴ�Ϊ��Mg2Al��4��
g/cm3���ʴ�Ϊ��Mg2Al��4��![]() ��
��

����Ŀ��������������ʱ����Ӧ������NOβ������Ҫ��Ⱦ��֮һ��NO���ѳ�������ת�������ǵ�ǰ�о����ȵ㡣��ش��������⣺
��1����֪��2NO(g)+O2 (g) =2NO2(g) ��H1�� -113kJ/mol
6NO2(g)+O3(g)=3N2O5(g) ��H2�� -227 kJ/mol
4NO2 (g)+O2(g)=2N2O5(g) ��H3�� -57 kJ/mol
�� 2O3(g)= 3O2(g)��_________��Ӧ������ȡ������ȡ��������� O3�����ѳ�����������ܷ�Ӧ��NO(g)+O3(g)=NO2(g)+O2(g) ��H4��_______kJ/mol�����NO2��_________����Ӧת��Ϊ����Ⱦ��������ѳ���
���� | ��Ӧ | ��� | ����Ӧ���ʷ��� | �淴Ӧ���ʷ��� |
I | 2NO(g) | Ea1 |
|
|
II | N2O2(g)��O2(g) | Ea2 |
|
|
��2����֪��2NO(g)��O2(g) ![]() 2NO2(g)�ķ�Ӧ���̷�������
2NO2(g)�ķ�Ӧ���̷�������
�ٱ���k1��k2��k3��k4��ֻ���¶ȱ仯�ij������¶����߽�ʹ����ֵ_____(�����С��)��
�ڷ�ӦI˲�佨��ƽ�⣬��˾���2NO(g)��O2(g)![]() 2NO2(g)��Ӧ���ʿ������Ƿ�ӦII����ӦI�뷴ӦII�Ļ�ܵĴ�С��ϵΪEa1____Ea2(�>����<������)����������Ч��ײ������̽����ԭ��______________________________________________��
2NO2(g)��Ӧ���ʿ������Ƿ�ӦII����ӦI�뷴ӦII�Ļ�ܵĴ�С��ϵΪEa1____Ea2(�>����<������)����������Ч��ײ������̽����ԭ��______________________________________________��
��һ���¶��£���Ӧ2NO(g)��O2(g)![]() 2NO2(g)�����ʷ���Ϊ
2NO2(g)�����ʷ���Ϊ![]() ����k=_______ (��k1��k2��k3��ʾ)��
����k=_______ (��k1��k2��k3��ʾ)��
��3����һ������ NO2��������ܱ������з������з�Ӧ��2NO2(g) ![]() 2NO(g)+O2(g)�������ƽ��ת���ʦ�(NO2)���¶ȱ仯��ͼ��ʾ���� b �㵽 a �㽵��ƽ�⽫��_____�ƶ���ͼ�� a���Ӧ�¶��£�NO2����ʼѹǿΪ 160kPa�����¶��·�Ӧ��ƽ�ⳣ��Kp= __________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)
2NO(g)+O2(g)�������ƽ��ת���ʦ�(NO2)���¶ȱ仯��ͼ��ʾ���� b �㵽 a �㽵��ƽ�⽫��_____�ƶ���ͼ�� a���Ӧ�¶��£�NO2����ʼѹǿΪ 160kPa�����¶��·�Ӧ��ƽ�ⳣ��Kp= __________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)









