题目内容
2.下列叙述中不正确的是( )| A. | 在离子化合物中也可能存在共价键 | |
| B. | 非金属元素之间的化学键不一定是共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含共价键的纯净物一定是共价化合物 |
分析 A.离子化合物一定含离子键,可能含共价键;
B.非金属元素之间可形成离子键,也可形成共价键;
C.离子化合物一定含离子键;
D.含共价键的纯净物可能为单质、共价化合物、离子化合物.
解答 解:A.离子化合物一定含离子键,可能含共价键,如NaOH中含离子键和O-H共价键,故A正确;
B.非金属元素之间可形成离子键,也可形成共价键,如铵盐中含离子键、共价键,故B正确;
C.离子化合物一定含离子键,则离子键一定存在于离子化合物中,故C正确;
D.含共价键的纯净物可能为单质、共价化合物、离子化合物,如氧气、HCl、NaOH中均含共价键,故D错误;
故选D.
点评 本题考查化学键及物质分类,为高频考点,把握化学键的形成及化合物中的化学键为解答的关键,侧重分析与应用能力的考查,注意利用实例分析,题目难度不大.

练习册系列答案
相关题目
12.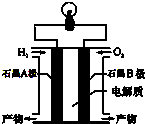 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池是一种能在航天飞机上使用的特殊电池,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 由于A、B两电极没有活动性差别,不能构成原电池 | |
| B. | A电极是负极,电极上发生氧化反应 | |
| C. | 产物为无污染的水,属于环境友好的绿色电池 | |
| D. | 外电路中电流由B电极通过导线流向A电极 |
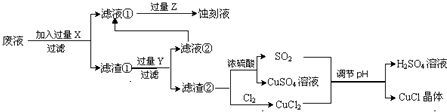
10.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
文字根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是离子交换膜电解槽.
(2)写出生产过程中X:Fe Y:HCl (填化学式).
(3)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是:防止CuCl水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体样品的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.
已知:CuCl+FeCl3═CuCl2+FeCl2
Fe2++Ce4+══Fe3++Ce3+
如此再重复二次测得:
④数据处理:计算得CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

文字根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是接触法,氯碱工业的装置是离子交换膜电解槽.
(2)写出生产过程中X:Fe Y:HCl (填化学式).
(3)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)生产中为了提高CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是减少CuCl的损失;生产过程中调节溶液的pH不能过大的原因是:防止CuCl水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是加速固体样品的溶解.
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次.
已知:CuCl+FeCl3═CuCl2+FeCl2
Fe2++Ce4+══Fe3++Ce3+
如此再重复二次测得:
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
17.根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.061 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应难易程度为L<Q | |
| C. | M与T形成的化合物能与氢氧化钠反应 | |
| D. | L2+与R2-的核外电子数相等 |
14.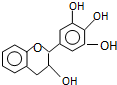 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如下图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 一定条件下的氧化产物能发生银镜反应 |
12.下列图示与对应的叙述相符的是( )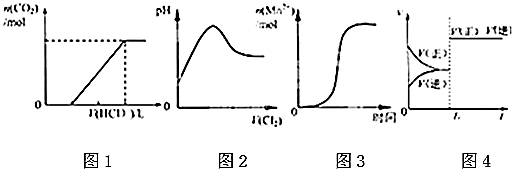

| A. | 图①表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图②表示0.1000 mol•L-1NaOH溶液滴定20.00mL 0.1000 mol•L-1HCl溶液所得到的滴定曲线 | |
| C. | 图③表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 | |
| D. | 图④表示某可逆反应生成物的量随反应时间变化的曲线,由图t时反应物转化率最大 |