题目内容
(12分)下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)
请按要求填空:
(1)A物质的化学式是 ;
(2)反应③的化学方程式是 ;
反应④的离子方程式是 ;
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是 ;
(4)检验溶液A中阳离子的方法是
;
(5)反应②中氧化剂是 ;
(1)NH4HCO3
(2)4NH3+5O2  4NO+6H2O Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O
4NO+6H2O Cu+4H++2NO3-===Cu2++2 NO2↑+2H2O
(3)6.02×1022
(4)取少许溶液A于试管,加入NaOH溶液,微热,能产生使湿润的红色石蕊试纸变蓝的气体,则说明有NH4+。 (5)CuO (每空2分)
解析试题分析:常温下B、D、F、G、I、J是气体,F、G是空气中的主要成分,分别为氧气、氮气中的一种,D是一种碱性气体,则D为NH3,E是一种黑色氧化物,H是紫红色金属单质,结合转化关系②可知,E为CuO、H为Cu,G为N2、C为H2O,故F为O2,由F与D得到I、I能与F继续反应生成J,则I为NO、J为NO2,J与C(H2O)反应生成K,K与H(Cu)反应得到二氧化氮,则K为HNO3,固体A分解得到氨气、水与气体B,B能与X反应得到F(氧气),则B为CO2,X为Na2O2;
⑴A中阴、阳离子个数比是1:1,故A为NH4HCO3;
⑵通过由上述分析可知,反应③的化学方程式是4NH3+5O2 4NO+6H2O;反应④的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
4NO+6H2O;反应④的离子方程式是Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
⑶反应①为2CO2+2Na2O2=2Na2CO3+O2,产生标准状况下1.12L氧气,其物质的量= =0.05mol,反应中氧元素由-1价升高为氧气中0价,转移电子的物质的量为0.05mol×2×[0-(-1)]=0.1mol,转移电子数为6.02×1022;
=0.05mol,反应中氧元素由-1价升高为氧气中0价,转移电子的物质的量为0.05mol×2×[0-(-1)]=0.1mol,转移电子数为6.02×1022;
⑷溶液A中阳离子为NH4+,检验NH4+的方法是:取少许溶液A于试管,加入NaOH溶液,微热,能产生使湿润的红色石蕊试纸变蓝的气体,则说明有NH4+;
⑸反应②是氨气与CuO反应生成氮气、Cu与水,反应中CuO转化Cu元素化合价由+2降低为0价,故CuO是氧化剂。
考点:考查无机框图推断。

下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
| A.①②③ | B.②③④ | C.③ | D.③⑤ |
某化学小组用下图所示装置制取氯气,下列说法不正确的是
| A.该装置图中至少存在两处明显错误 |
| B.烧瓶中的MnO2可换成KMnO4 |
| C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
| D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
下列有关氯气的叙述中不正确的是( )
| A.氯气是一种黄绿色,有刺激性气味的气体 |
| B.氯气,液氯,氯水是同一种物质 |
| C.氯气能溶于水 |
| D.氯气是一种有毒气体 |
(17分)Na2SO3固体在空气中久置容易变质 。
(I)Na2SO3固体在空气中变质的主要原因,用化学方程式表示为 。
(II)为探究Na2SO3样品的变质情况,现提出以下假设:
假设1:Na2SO3样品完全变质; 假设2:Na2SO3样品完全没有变质;假设3: 。
补充完成以下实验过程及现象和结论,完成探究。
| 实验操作 | 现象和结论 |
| 步骤1:取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加H2SO4酸化的KMnO4溶液; | 现象:若KMnO4溶液的紫红色褪为无色 ①结论:样品中有 离子,假设1不成立。 ②褪色的离子方程式为: 。 |
| 步骤2:另取少许样品于试管中,加入适量蒸馏水充分溶解,再滴加稀HCl,使溶液呈酸性,再滴加适量BaCl2溶液; | ③现象:若 ; 结论:假设2成立。 |
| …… | …… |
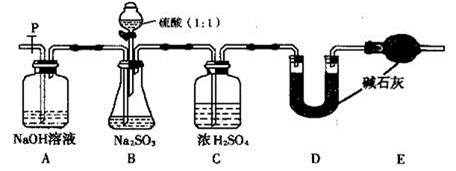
检查B装置气密性的操作为 。
(2)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(3)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 处(填图中字母)装置实验前后的质量差。

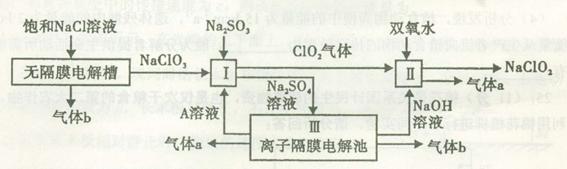
 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中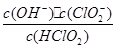 = 。
= 。