��Ŀ����
����Ŀ��������������⣺
(1)Cl2��ˮ����ͨ�����ȵ�̿������HCl��CO2������1 mol Cl2���뷴Ӧʱ�ͷ�145 kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ____________________________��
(2)��֪CH3OH(l)��ȼ����Ϊ238.6 kJ��mol��1��CH3OH(l)��1/2O2(g) ��CO2(g)��2H2O(g) ��H����a kJ��mol��1����a_______238.6(ѡ������������������������)��
(3)��֪��As(s)+3/2H2(g)+2O2(g)=H3AsO4(s) ��H1
H2(g)+1/2O2(g)=H2O(l) ��H2
2As(s)+5/2O2(g) =As2O5(s) ��H3
��ӦAs2O5(s) +3H2O(l)= 2H3AsO4(s)����H =_________��
(4)��֪��һ���¶�����
C(s)+ CO2(g)![]() 2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1
C(s)+ H2O(g)![]() CO(g)+ H2(g) ƽ�ⳣ�� K2
CO(g)+ H2(g) ƽ�ⳣ�� K2
CO(g)+ H2O(g)![]() H2(g)+ CO2(g)ƽ�ⳣ��K3
H2(g)+ CO2(g)ƽ�ⳣ��K3
��K1��K2��K3֮��Ĺ�ϵ��__________________________��
���𰸡�2Cl2(g)��2H2O(g)��C(s)=4HCl(g)��CO2(g) ��H����290 kJ��mol��1 �� 2��H1-3��H2-��H3 K3= K2/ K1 (K1= K2/K3��K2=K1��K3)
��������
���ݷ�Ӧ�������ʵ����йأ�Ҳ�����ʵ�״̬�йؽ��з��������ݷ�Ӧ���뷴Ӧǰ��������йأ�������ؽ��з�����
(1)�����Ȼ�ѧ����ʽ��ϵ��Ϊ���ʵ���������1 mol Cl2���뷴Ӧʱ�ͷ�145 kJ���������Ȼ�ѧ����ʽΪ��2Cl2(g)��2H2O(g)��C(s)=4HCl(g)��CO2(g) ��H����290 kJ��mol��1��
(2) ��֪CH3OH(l)��ȼ����Ϊ238.6 kJ��mol��1��ȼ������ָ�����ȶ��������������Һ̬ˮʱ�����������Ե���Ӧ������̬ˮʱ����Ӧ�ų��������٣���a��238.6��
(3)���ݸ�˹���ɷ�������As(s)+3/2H2(g)+2O2(g)=H3AsO4(s) ��H1 ����H2(g)+1/2O2(g)=H2O(l) ��H2����2As(s)+5/2O2(g) =As2O5(s) ��H3 ���١�2-3����-�����ɵ��Ȼ�ѧ����ʽΪAs2O5(s) +3H2O(l)= 2H3AsO4(s)����H =2��H1-3��H2-��H3��
(4) ��C(s)+ CO2(g)![]() 2CO(g) ƽ�ⳣ��K1=
2CO(g) ƽ�ⳣ��K1=![]() ����C(s)+ H2O(g)
����C(s)+ H2O(g)![]() CO(g)+ H2(g) ƽ�ⳣ�� K2=
CO(g)+ H2(g) ƽ�ⳣ�� K2=![]() ,
,
���Ը��ݸ�˹��������-�ٿɵ��Ȼ�ѧ����ʽ��CO(g)+ H2O(g)![]() H2(g)+ CO2(g) ��ƽ�ⳣ��K3=
H2(g)+ CO2(g) ��ƽ�ⳣ��K3= ![]() =K2/ K1��
=K2/ K1��

����Ŀ����һ���¶��¡�1L�ܱ������У�3��������ʼ״̬��ƽ��״̬ʱ�����ʵ�����n�����±���ʾ�������й�˵����ȷ����
x | y | w | |
n(��ʼ)��mol | 2 | l | 0 |
n(ƽ��)��mol | l | 0.5 | 1.5 |
A. ���¶��£��˷�Ӧ��ƽ�ⳣ������ʽ��![]()
B. �����¶ȣ���w�����������С����˷�Ӧ��H>0
C. ����ѹǿ�������淴Ӧ���ʾ�����ƽ��������Ӧ�����ƶ�
D. ���¶��£�����������ͨ��3molw���ﵽƽ��ʱ��n(x)=2mol
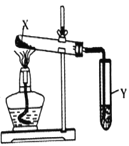
����Ŀ����ͼװ�ý���ʵ�飬�����������ƶϳ����۵��ǣ� ��
ѡ�� | �Լ�X | Y���Լ������� | ���� | װ�� |
A | һ���� | ��̪��Һδ��� | ���β���������� |
|
B | С�մ�ʹ��� | ʯ��ˮ����� | �����С�մ��ȶ� | |
C | �����������Ȼ�� | ��������Һ���Ȳ����������ܽ� | Ag2O�����ڰ�ˮ | |
D | �������������� | ���ۡ��⻯�غͺ�����Ļ����Һ���� | ��Ӧ������Cl2 |
A. A B. B C. C D. D