��Ŀ����
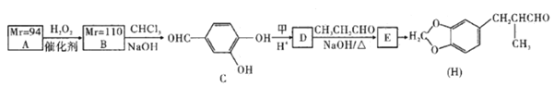
����Ŀ��ij���᳧�Ժ���SO2��β����������Ϊԭ�ϣ��ϳ�����ҪӦ�ü�ֵ���ơ�����ء�������淋����ʡ��ϳ�·�����£�
��1��д����Ӧ��Ļ�ѧ����ʽ��___________________________________________��
��2�������й�˵����ȷ����_________������ĸ��
A����Ӧ��������������������Ա�֤�����������������������
B����Ӧ��ͷ�Ӧ��Ļ�����Ӧ������ͬ
C����Ӧ���������60��70�棬Ŀ��֮һ�Ǽ���̼����淋ķֽ�
D����Ӧ���еĸ������Ȼ�刺���������
��3����NH4��2SO3�����ڵ糧���̵������ѵ�������������ת��Ϊ������ͬʱ����һ�ֵ��ʣ��γɹ���ϵͳ��д������������������立�Ӧ�Ļ�ѧ����ʽ��___________��
��4���ܶ����᳧Ϊ��������SO2��ֱ���ð�ˮ���շ�����β����
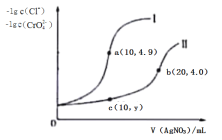
�� ��15.0 mL 2.0 mol/L��ˮ���ձ�״����448 mL SO2������Һ�е�����Ϊ_______��
�� ijͬѧ������KMnO4��Һ�ζ���������Һ�����ﵽ�ζ��յ�ʱ������KMnO4��Һ25.00 mL��������KMnO4��Һ��c(KMnO4) =_________________��
��5��������;�㷺������ֱ������ȼ�ϵ�أ���ͼ���ð�ˮ��ԭ�ϵ�ȼ�ϵ�صĹ���ԭ����
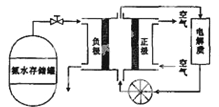
����ȼ�ϵ�صĵ������Һ���ѡ��________������ԡ��������ԡ������ԡ�����Һ������ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ������������ˮ���õ���ܷ�Ӧ�Ļ�ѧ����ʽ��___________�������ĵ缫��Ӧʽ��_________________________��
���𰸡�CaSO4+4C![]() CaS+4CO�� ACD 4��NH4��2SO3+2NO2=4��NH4��2SO4+N2 ��NH4��2SO3��NH4HSO3 0.32mol/L ���� 4NH3+3O2=2N2+6H2O 2NH3-6e-+6OH-=N2+6H2O
CaS+4CO�� ACD 4��NH4��2SO3+2NO2=4��NH4��2SO4+N2 ��NH4��2SO3��NH4HSO3 0.32mol/L ���� 4NH3+3O2=2N2+6H2O 2NH3-6e-+6OH-=N2+6H2O
��������
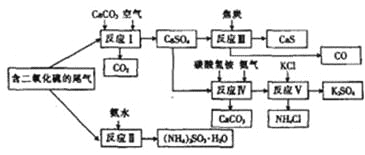
��1��������ͼ��֪��ӦIII��������뽹̿�ڸ��������·�Ӧ����CaS��CO����ѧ����ʽΪCaSO4+4C![]() CaS+4CO����
CaS+4CO����
(2)A����ӦI�й��������Ŀ���Ŀ�ľ���ʹ���������ֱ�����Ϊ����ƣ���ȷ��B����ӦII�Ƕ��������백ˮ�Ļ��Ϸ�Ӧ������ӦIII�����ڻ�����Ӧ���ͣ����ߵĻ�����Ӧ���Ͳ�ͬ������C����Ӧ���������60��70�棬��ֹ̼��������¶ȹ���ʱ�ֽ�ò�����Ҫ��Ŀ������ȷ��D����ӦV�IJ���֮һ���Ȼ�泥�����NԪ�أ����������ʣ���ȷ����ѡACD��
��3������������������立�Ӧ��������������ǿ������������������立�Ӧ����������泥���������ԭΪ��������ԭ���غ��֪��ѧ����ʽΪ4��NH4��2SO3+2NO2=4��NH4��2SO4+N2��
��4���ٱ�״����448 mL SO2�����ʵ�����0.02mol�����������ʵ�����0.015L��2.0mol/L=0.03mol�����������백�������ʵ���֮��1/2<2/3<1����������Һ�е����ʼ��У�NH4��2SO3��Ҳ��NH4HSO3��
����KMnO4��Һȥ�ζ�����Һ��ʵ���Ǹ���������������Ӧ�����ݵ�ʧ�����غ㣬0.02mol��������ʧȥ���ӵ����ʵ�����0.02mol��2=0.04mol�����������MnԪ�ػ��ϼ۽���Ϊ+2�ۣ���0.025L��5��c=0.04mol�����Ը�����ص�Ũ��c=0.32mol/L��
��5������ȼ�ϵ���еĵ������Һ���ѡ�������Һ����Ϊ�÷�Ӧ��ʵ���ǰ�����������Ӧ�����Ծ������ٰ�������Һ�е��ܽ�ȣ���������ˮ�Լ��ԣ��������ڼ�����Һ�е��ܽ����С������ѡ�������Һ����������������һ�ֳ������������ˮ�����������ǵ����������ܷ�Ӧ�ķ���ʽΪ4NH3+3O2=2N2+6H2O����������������Ӧ�����ܷ�Ӧ����ʽ�пɿ�����NԪ�صĻ��ϼ����ߣ�����������������Ӧ����ϵ������Һ�����ķ�ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��

����Ŀ����25 ��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/(mol��L��1) | 0.1 | 0.2 | 0 |
ƽ��Ũ��/(mol��L��1) | 0.05 | 0.05 | 0.1 |
����˵���������(����)
A.����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
B.��Ӧ�ɱ�ʾΪX��3Y![]() 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600
C.��Ӧ��ƽ��ʱ��X��ת����Ϊ50%
D.�ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
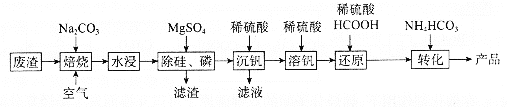
����Ŀ������ijұ����ҵ�����ķ���(��Ҫ��![]() ����������
����������![]() ��
��![]() ������)�����Ʊ�
������)�����Ʊ�![]() �������������£�
�������������£�
��֪��![]() ����ˮ�����ڼ�����
����ˮ�����ڼ�����![]() (��������
(��������![]() )������ǿ�����ԡ���
)������ǿ�����ԡ���![]() ��Һ�м��ᣬ��ͬ
��Һ�м��ᣬ��ͬ![]() ��Ӧ����Ҫ������ʽ�����
��Ӧ����Ҫ������ʽ�����
|
| 10.6~12 | Լ8.4 | 3~8 | Լ2 | <1 |
������ʽ |
|
|
|
|
|
|
�ش��������⣺
(1)����������VԪ��ת��Ϊ![]() ��
��![]() Ԫ��ת��Ϊ________(д��ѧʽ)��
Ԫ��ת��Ϊ________(д��ѧʽ)��
(2)��������Ԫ��(��![]() )��������Һ��
)��������Һ��![]() ��Ũ������Ϊ________
��Ũ������Ϊ________![]() (��֪
(��֪![]() )��
)��
(3)�������������У�![]() ��8.5��5.0������Ӧ�����ӷ���ʽΪ________��������Ҫ����
��8.5��5.0������Ӧ�����ӷ���ʽΪ________��������Ҫ����![]() ԼΪ________�������������յõ�����Ҫ����������________(д��ѧʽ)��
ԼΪ________�������������յõ�����Ҫ����������________(д��ѧʽ)��
(4)����ԭ������ת������������Ҫ��Ӧ�����ӷ���ʽ��Ϊ________��________��