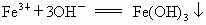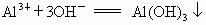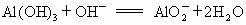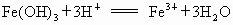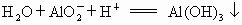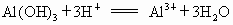题目内容
怎样将氯化铝和氯化铁的混合溶液分离成氯化铝和氯化铁两种溶液?写出简要实验操作步骤和有关离子方程式.
答案:略
解析:
解析:
|
欲分离 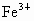 和 和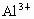 必须利用 必须利用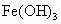 只溶于强酸而不溶于强碱,而 只溶于强酸而不溶于强碱,而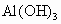 既溶于强酸又溶于强碱的性质差异. 既溶于强酸又溶于强碱的性质差异.
在解决物质分离题目时应遵循两条原则: ①欲将另一种离子沉淀时所加沉淀剂必须过量; ②为分离含其他离子杂质的沉淀,对沉淀必须用蒸馏水洗涤 2~3次.然后再溶于酸得欲分离的溶液.故本题答案为:(1) 向混合溶液中加入过量的NaOH溶液,洗涤过滤.将滤渣洗涤后,溶于盐酸得溶液.
(2) 在滤液中滴入过量盐酸,洗涤过滤.
(3) 再过滤.将沉淀经洗涤后,用盐酸溶解,得
(1) 为使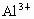 、 、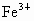 完全分离,步骤(1)所加NaOH溶液必须过量,这是答题时应考虑的. 完全分离,步骤(1)所加NaOH溶液必须过量,这是答题时应考虑的.
(2) 在②、③两步中,洗涤沉淀的目的是洗去沉淀里吸附的可溶性杂质离子,这属较高层次要求,答题时洗涤操作不写会扣分.(3) 在③步中,若加入过量盐酸.直接得到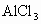 的溶液,因混有 的溶液,因混有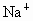 使制得 使制得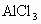 溶液不纯. 溶液不纯. |

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目