题目内容
 第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:
第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:(1)Ga的基态原子的价电子的轨道排布式为
1s22s22p63d104s24p1
1s22s22p63d104s24p1
.(2)下列说法正确的是
AC
AC
(选填序号).A.砷和镓都属于p区元素 B.GaN、GaP、GaAs均为分子晶体
C.电负性:As>Ga D.第一电离能Ga>As
(3)GaAs是由(CH3)3Ga和AsH3在一定条件下制得,同时得到另一物质,该物质分子是
非极性分子
非极性分子
(填“极性分子”或“非极性分子”).(CH3)3Ga中镓原子的杂化方式为sp2
sp2
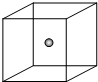
.(4)如图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
分析:(1)镓是31号元素,其原子核外有31个电子,根据构造原理书写其基态原子核外电子排布式;
(2)金属性越强,第一电离能越小,非金属性越强,电负性越大,由最后填充的电子来分析在周期表中的位置;
(3)(CH3)3Ga+AsH3
GaAs+3CH4;利用价层电子对互斥模型判断分子的空间构型可杂化方式;
(4)晶体硅中每个硅原子和四个硅原子形成四个共价键,如果一个硅原子在正方体体心上,4个硅原子在相对的4个顶点上.
(2)金属性越强,第一电离能越小,非金属性越强,电负性越大,由最后填充的电子来分析在周期表中的位置;
(3)(CH3)3Ga+AsH3
| ||
(4)晶体硅中每个硅原子和四个硅原子形成四个共价键,如果一个硅原子在正方体体心上,4个硅原子在相对的4个顶点上.
解答:解:(1)镓位于周期表中第四周期第IIIA,故其核外电子排布式为1s22s22p63d104s24p1或[Ar]3d104s24p1,
故答案为:1s22s22p63d104s24p1;
(2)A.因砷和镓的电子排布中最后填充的是p电子,则都属于p区元素,故A正确;
B.GaN、GaP、GaAs晶体结构与单晶硅相似,属于原子晶体,故B错误;
C.Ga的金属性强,则第一电离能小,电负性小,故C正确;
D.Ga的金属性强,则第一电离能小,电负性小,故D错误;
故选AC.
(3)反应为(CH3)3Ga和AsH3,生成为GaAs,根据质量守恒可知还应有和CH4,甲烷是非极性分子;(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:非极性分子;sp2;
(4)晶体硅中每个硅原子和四个硅原子形成四个共价键,如果一个硅原子在正方体体心上,4个硅原子在相对的4个顶点上,所以为: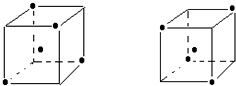 ,故答案为:
,故答案为: .
.
故答案为:1s22s22p63d104s24p1;
(2)A.因砷和镓的电子排布中最后填充的是p电子,则都属于p区元素,故A正确;
B.GaN、GaP、GaAs晶体结构与单晶硅相似,属于原子晶体,故B错误;
C.Ga的金属性强,则第一电离能小,电负性小,故C正确;
D.Ga的金属性强,则第一电离能小,电负性小,故D错误;
故选AC.
(3)反应为(CH3)3Ga和AsH3,生成为GaAs,根据质量守恒可知还应有和CH4,甲烷是非极性分子;(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,
故答案为:非极性分子;sp2;
(4)晶体硅中每个硅原子和四个硅原子形成四个共价键,如果一个硅原子在正方体体心上,4个硅原子在相对的4个顶点上,所以为:
 ,故答案为:
,故答案为: .
.点评:本题考查原子结构、晶体类型、非极性分子等,题目难度较大,注意在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,此点为易错点.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
Ⅰ.第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似。试回答:
(1)Ga的基态原子的价电子的轨道排布式为 。
(2)下列说法正确的是 (选填序号)。
A.砷和镓都属于p区元素 B.GaN、GaP、GaAs均为分子晶体
C.电负性:As>Ga D.第一电离能Ga>As
(3)GaAs是由(CH3)3Ga和AsH3在一定条件下制得,同时得到另一物质,该物质分子是 (填“极性分子”或“非极性分子”)。(CH3)3Ga中镓原子的杂化方式为 。
Ⅱ.氧化钙晶体的晶胞如图所示,试回答:

(1)晶体中Ca2+的配位数为 。
(2)已知Ca2+的半径为a cm,O2-的半径为b cm,NA代表阿伏加德罗常数,
该晶体的密度为 g/cm3。(用含a、b、NA的代数式表示)
