题目内容
【题目】(1)绿矾晶体(FeSO4﹒7H2〇)由于保存不妥或长久放置,容易部分或全部被氧化,现有一瓶绿矾样品,想了解其是否被氧化和被氧化的程度,试选择合适的试剂,根据相关的实验现象进行推测(可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液等)。
①证明其完全没有被氧化的试剂是 现象是__________________;
②证明其已完全被氧化的试剂是 现象是____________________。
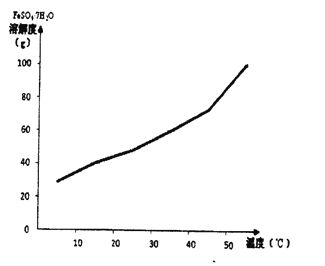
(2)己知FeSO4.7H2O的溶解度曲线如下图所示,则从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是__________________。
(3)黄色固体聚合硫酸铁(SPFS)是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水
处理等领域具有重要的应用。SPFS可表示成SPFS可表示成Fex(OH)y(SO4)znH2O.工业上常用的一种制备流程为:
![]()
取5.349g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀8.155g,向上述滤液中加入NH3H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.000g.确定该固体聚合硫酸铁样品的化学式。(写计算过程)
【答案】(1)①KSCN溶液,加入KSCN不变红色②滴入酸性KMnO4溶液不褪色
(2)降温结晶、过滤(2分)(3)Fe25(OH)5(SO4)35·28H2O(4分)
【解析】试题分析:(1)①绿矾中的亚铁离子被氧化成铁离子,遇KSCN变红色,因此加入KSCN溶液,若溶液不变红证明完全没有被氧化;②酸性KMnO4可氧化亚铁离子,但不与铁离子反应,若溶液的紫色不退去,证明已完全被氧化;
(2)硫酸亚铁的溶解度随温度的升高而升高,因此从硫酸亚铁饱和溶液中提取绿矾晶体采用的操作是降温结晶、过滤。
(3)白色沉淀8.155g是硫酸钡,物质的量是8.155g÷233g/mol=0.035mol,氧化铁的物质的量是2g÷160g/mol=0.0125mol,根据铁原子守恒可知铁原子的物质的量是0.025mol,根据电荷守恒得:n(OH-)=3n(Fe3+)-2 n(SO42-)="0.005" mol,所以晶体中水分子的物质的量是![]() =0.028mol,所以铁离子、氢氧根、硫酸根和水的物质的量之比是0.025mol:0.005mol:0.035mol:0.028mol=25:5:35:28,因此化学式为Fe25(OH)5(SO4)35·28H2O,
=0.028mol,所以铁离子、氢氧根、硫酸根和水的物质的量之比是0.025mol:0.005mol:0.035mol:0.028mol=25:5:35:28,因此化学式为Fe25(OH)5(SO4)35·28H2O,




