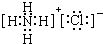题目内容
下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、D是金属单质,L为红褐色沉淀,E为食盐的主要成分,I的水溶液呈强酸性。
(1)写出反应①的化学方程式:______________________________________。
(2)写出反应②的离子方程式:______________________________________。
(3)向M溶液中加入足量的I溶液反应的离子方程式为______________________。
(4)写出一个由化合反应生成L的化学方程式______________________________。
(8分,每空2分)
(1)2Al + Fe2O3  2 Fe + Al2O3 (若高温条件不写扣1分,不配平不得分)
2 Fe + Al2O3 (若高温条件不写扣1分,不配平不得分)
(2)2Cl- +2H2O  Cl2↑+ H2↑+ 2OH-(若电解条件不写扣1分,不配平不得分,写成化学方程式不得分)
Cl2↑+ H2↑+ 2OH-(若电解条件不写扣1分,不配平不得分,写成化学方程式不得分)
(3)AlO2- + 4H+=Al3+ + 2H2O(若写2步反应的离子方程式且正确也给分,写成化学方程式不得分)
(4)4Fe(OH)2 + O2 + 2H2O =4Fe(OH)3
解析试题分析:L为红褐色沉淀,则L是氢氧化铁。氢氧化铁分解生成氧化铁,则B是氧化铁。A、D是金属单质,则根据反应①的条件可知,A应该是Al,D是Fe,C是氧化铝。N加热分解生成氧化铝,所以N是氢氧化铝。E为食盐的主要成分,即E是氯化钠。电解氯化钠溶液生成氢氧化钠、氢气和氯气。G和H反应生成I,I的水溶液呈强酸性,这说明I是氯化氢,乙醇G和H是氢气和氯气,则F是氢氧化钠。氢氧化钠溶解氧化铝生成偏铝酸钠,即M是偏铝酸钠,偏铝酸钠和盐酸反应生成可以生成氢氧化铝。铁和盐酸反应生成氯化亚铁和氢气,所以H是氢气,G是氯气。氯气和氯化亚铁反应生成氯化铁,即K是氯化铁。氯化铁和氢氧化钠反应生成氢氧化铁红褐色沉淀。
考点:考查无机框图题的推断
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。

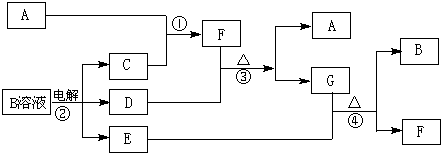
(15分)下图为中学化学中几种常见物质之间的转化关系。已知:(1)A、C、D是常见的气体单质,(2)F气体极易溶于水,且液态常用做制冷剂。(3)G为易溶性的盐,E为白色沉淀。(4)H为无色液体化合物。
|

 (1)写出G的电子式 ,
(1)写出G的电子式 ,(2)鉴定G中阳离子的实验方法和现象___________________________ _;
(3)反应②的离子方程式 。
(4)反应③的化学方程式 。
(5)将等物质的量的F与G溶于水,所得溶液pH>7,则该溶液中各种离子浓度大小顺序为: 。