题目内容
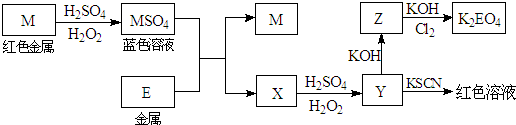
(10分)已知:![]() H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:(M、E等字母用所对应的元素符号表示)
H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:(M、E等字母用所对应的元素符号表示)

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: ▲ 。
(2)某同学取X的溶液,加入少量稀硫酸酸化后露置于空气中一段时间,颜色变黄,再加入KI、淀粉溶液,又变为蓝色。分别写出上述变黄过程和变蓝过程所发生相关反应的离子方程式: ▲ 、 ▲ 。
(3)写出Y到Z变化过程的离子方程式: ▲ 。
(4)写出Cl2将Z氧化为K2EO4的化学方程式: ▲ 。
(10分)每空2分。www..com
(1)Cu+H2O2+H2SO4=CuSO4+2H2O
(2)4Fe2++O2+4H+=4Fe3++2H2O 2Fe3++2I—=2Fe2++I2
(3)Fe3++3OH—=2Fe(OH)3↓
(4)10KOH+3Cl2+2Fe(OH)3=2K2FeO4+6KCl+8H2O

练习册系列答案
相关题目
(10分)已知:![]() H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:
H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:
| |

(1)试推断金属M、E分别是(填元素符号): ▲ 、 ▲ 。Z的化学式: ▲ 。
(2)某同学取X的溶液,加入少量稀硫酸酸化后露置于空气中一段时间,颜色变黄,再加入KI、淀粉溶液,又变为蓝色。试判断X、Y中的金属阳离子分别是: ▲ 、 ▲ 。