题目内容
【题目】下列说法正确的是
A. 25℃时,0.1 mol·L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)减小
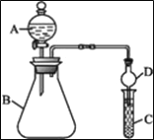
B. 将下图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深

C. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
D. SiO2(s)+2C(s)=Si(s)+2CO(g)只能在高温下自发进行,则该反应△H>0
【答案】BD
【解析】
A、CH3COOH溶液加水稀释,根据电离平衡的移动来分析.
B、改变影响平衡的一个条件,平衡向能够减弱这种改变的方向移动;
C、等体积pH=13的NaOH溶液和pH=3的CH3COOH溶液混合后所得的溶液为醋酸钠溶液和过量的醋酸.
D、反应为气体体积增大的反应,所以熵增大,根据自发进行△H-T△S<0判断;
A、加水稀释,平衡中醋酸分子浓度c(CH3COOH)和c(H+)均变小,水的离子积Kw不变,故c(OH-)增大,从而c(OH-)/c(CH3COOH)增大,故A错误;
B、将图中的活塞快速推至A处,则气体的浓度瞬间增大,故颜色瞬间变深,但由于增大压强后平衡2NO2![]() N2O4右移,故颜色又逐渐变浅,但由于平衡的移动只能减弱改变,故颜色变浅后还是比原来的深,故B正确;
N2O4右移,故颜色又逐渐变浅,但由于平衡的移动只能减弱改变,故颜色变浅后还是比原来的深,故B正确;
C、等体积pH=13的NaOH溶液和pH=3的CH3COOH溶液混合后所得的溶液为醋酸钠溶液和过量的醋酸,过量的醋酸使溶液显酸性,故pH<7,故C 错误。
D、该反应为气体体积增大的反应,所以熵增大,又只能在高温下自发进行,即在高温下△H-T△S<0,所以△H>0,故D正确;
故选BD。

【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
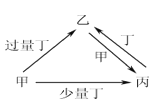
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D
【题目】在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)![]() 2C(g)+D(s)
2C(g)+D(s)
△H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
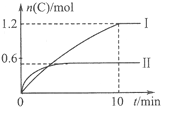
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
A. 实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B. 上述方程式中a=-160
C. 600℃时,该反应的平衡常数是1.5
D. 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率减小