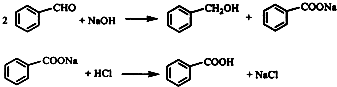
题目内容
(1)为了除去下列物质中的少量杂质(括号内位杂质).请在空白处填入适当的试剂:
(2)在 K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中.此反应若转移了0.3mol的电子,则生成氯气
| 物质 | 试剂 | 物质 | 试剂 | CuO(Al2O3) | 氢氧化钠 氢氧化钠 |
Si02(CaO) | 稀盐酸 稀盐酸 |
NaHCO3溶液(Na2CO3) | 二氧化碳 二氧化碳 |
Fe(Al) | 氢氧化钠溶液 氢氧化钠溶液 |
3.36
3.36
L(标准状况下)分析:(1)要除去物质中混有的杂质,可以根据物质的性质,要求所选择的除杂试剂只与杂质反应,不能与原有物质反应,且反应后不能生成新的杂质;
(2)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气0.15mol,根据V=nVm计算.
(2)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气0.15mol,根据V=nVm计算.
解答:解:(1)Al2O3能溶于氢氧化钠而氧化铜不能;
CaO能溶于稀盐酸而Si02不能;
Na2CO3能与二氧化碳反应生成碳酸氢钠;
铝能与氢氧化钠溶液反应生成偏铝酸钠,而铁不反应;
故答案为:氢氧化钠;稀盐酸;二氧化碳;氢氧化钠溶液;
(2)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气0.15mol,在标准状况下的体积为0.15mol×22.4L/mol=3.36L,
故答案为:3.36.
CaO能溶于稀盐酸而Si02不能;
Na2CO3能与二氧化碳反应生成碳酸氢钠;
铝能与氢氧化钠溶液反应生成偏铝酸钠,而铁不反应;
故答案为:氢氧化钠;稀盐酸;二氧化碳;氢氧化钠溶液;
(2)反应中Cl元素化合价由-1价升高到0价,若转移了0.3mol的电子,则生成氯气0.15mol,在标准状况下的体积为0.15mol×22.4L/mol=3.36L,
故答案为:3.36.
点评:本题考查除杂和氧化还原反应知识,题目难度不大,注意把握元素化合价的升降的判断,根据元素化合价的变化判断得失电子的数目.

练习册系列答案
相关题目
 ?
?