题目内容
4.下列推论正确的( )| A. | SiH4的沸点高于CH4,可推测PH3的沸点也高于NH3 | |
| B. | CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体 | |
| C. | PCl3 为三角锥形,可推测NF3也为三角锥形结构 | |
| D. | C2H6的碳链是直线型的,可推测C3H8的碳链也是直线型的 |
分析 A、NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点;
B、二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体;
C、PCl3和NF3结构类似都是三角锥形;
D、C3H8是锯齿形结构.
解答 解:A、氨气分子间存在氢键,氢键能增大物质的沸点,所以NH3和PH3比较,NH3中含有氢键沸点大,故A错误;
B、二氧化硅是由硅原子和氧原子按照个数比1:2通过Si-O键构成原子晶体,不是分子晶体,故B错误;
C、PCl3为三角锥形,NF3也为三角锥形结构,结构类似,故C正确;
D、C3H8是锯齿形结构,3个碳原子不在同一直线上,故D错误;
故选C.
点评 本题考查较为综合,涉及晶体沸点高低的比较、晶体类型以及分子的空间结构等问题,题目难度不大,注意烷烃的结构特点.

练习册系列答案
相关题目
15.电解普通水(H2O)和重水(D2O)的混合物,通电一段时间后,两极共生成气体18.5g,其体积为33.6L(标况下),在所生成的气体中重氢和普通氢的原子个数比为( )
| A. | 2:3 | B. | 2:5 | C. | 1:2 | D. | 1:3 |
12.能发生消去反应,生成物中存在同分异构体的是( )
| A. | 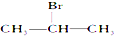 | B. | 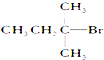 | C. | 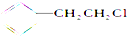 | D. | CH3CH2Br |
19.下列说法正确的是( )
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
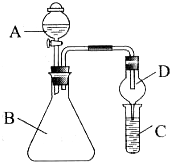
9.用如图所示装置进行实验,装置正确且设计合理的是( )
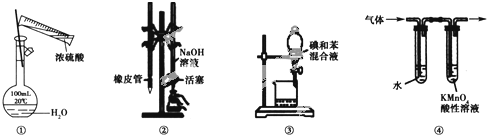

| A. | 图①所示装置进行浓硫酸稀释配制稀硫酸的实验 | |
| B. | 图②所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验 | |
| C. | 图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出 | |
| D. | 图④所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯 |
16.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
| A. | Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 | |
| B. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp[CaSO4] | |
| C. | 已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应Fe(OH)3+3H+?Fe3++3H2O的平衡常数K=4.0×104 | |
| D. | 已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol•L-1 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol ${\;}_{8}^{16}$OD- 离子含有的质子、中子数均为1.0NA | |
| B. | 含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA | |
| C. | 3.6 g石墨中,含有共价键数为0.3NA | |
| D. | 标准状况下,4.48 L己烷含有的分子数为0.2NA |
14.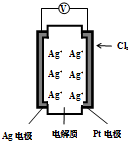 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |