题目内容
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)![]() H2(g)+I2(g) ΔH<0
H2(g)+I2(g) ΔH<0
(1)该反应平衡常数的表达式为K=___,则H2(g)+I2(g)![]() 2HI(g)平衡常数的表达式为K1___
2HI(g)平衡常数的表达式为K1___![]() 用K表示
用K表示![]() 。
。
(2)当反应达到平衡时,c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为___,HI的分解率为___。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0,则该时刻,反应向___![]() 填“正向”或“逆向”,下同
填“正向”或“逆向”,下同![]() 进行,若升高温度,反应向___进行。
进行,若升高温度,反应向___进行。
【答案】![]()
![]() 0.5mol/L 20% 正向 逆向
0.5mol/L 20% 正向 逆向
【解析】
(1)化学平衡常数=![]() ,据此进行解答;
,据此进行解答;
(2)据化学方程式可知,生成0.5mol碘单质分解了1mol HI,反应开始前HI浓度为5mol/L,分解率=![]() ×100%;
×100%;
(3)据Qc与K大小判断反应方向;该反应为放热反应,根据平衡向右的原理判断。
(1)反应2HI(g)![]() H2(g)+I2(g)的平衡常数表达式为:K=
H2(g)+I2(g)的平衡常数表达式为:K=![]() ,H2(g)+I2(g)
,H2(g)+I2(g)![]() 2HI(g)平衡常数的表达式为K1=
2HI(g)平衡常数的表达式为K1= =
=![]() ;
;
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,根据反应2HI(g)![]() H2(g)+I2(g)可知,平衡时c(H2)=c(I2)=0.5mol/L,反应消耗HI的浓度为:c(HI)消耗=2c(H2)═1mol/L,则反应前HI的总浓度为:4mol/L+1mol/L=5mol/L,所以HI的分解率为:
H2(g)+I2(g)可知,平衡时c(H2)=c(I2)=0.5mol/L,反应消耗HI的浓度为:c(HI)消耗=2c(H2)═1mol/L,则反应前HI的总浓度为:4mol/L+1mol/L=5mol/L,所以HI的分解率为:![]() ×100%=20%;
×100%=20%;
(3)容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则此时浓度商Qc=![]() =
=![]() =0.25<K=1,表明反应物浓度较大,平衡正向着正向移动;该反应的△H<0,为放热反应,则升高温度后平衡向着吸热的逆向移动。
=0.25<K=1,表明反应物浓度较大,平衡正向着正向移动;该反应的△H<0,为放热反应,则升高温度后平衡向着吸热的逆向移动。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)![]() CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)![]() CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)的ΔH= ;
CH3OCH3(g) + CO2(g)的ΔH= ;
【题目】下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
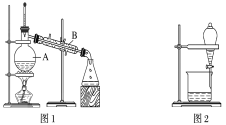
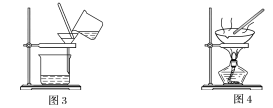
(1)装置图1中B的名称是________________,图2中漏斗的名称是________________。A中一般要加入碎瓷片,其作用是__________________________。下列关于以上实验操作说法一定正确的是_。
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度
D.图4实验中,当加热至有较多固体析出时,即停止加热
(2)现有一瓶A和B的混合液,已知它们的性质如下表。
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B相互分离可选用上图中的图________________所示仪器。
(3)在图2所示实验中,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。____。

