题目内容
向一定量的Fe、FeO、Fe2O3混合物中加入1.00mol·L-1的盐酸100mL,可恰好使混合物完全溶解,放出224mL(标准状况)的气体.向所得溶液中加入KSCN溶液,无血红色出现.
(1)若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是多少?
(2)求原混合物中铁元素的质量分数
解析:
|
(1)解一:设混合物中Fe、FeO、Fe2O3物质的量分别为x、y、z. 反应:Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、 z 6z 2z y 2y y Fe+2FeCl3=3FeCl2、 Fe+ 2HCl = FeCl2+H2↑ z 2z 3z (x-z) 2(x-z) (x-z) (x-z) ∵6z+2y+2(x-z)=2x+2y+4z=0.1L×1mol·l-1=0.1mol ∴铁的物质的量=(2x+2y+4z)=0.1mol÷2=0.05mol ∴铁的质量=0.05mol×56g·mol-1=2.80g 解二:由反应可知最后溶液为FeCl2溶液,其中所含铁的质量与一氧化碳还原所得的铁等量. ∵ ∴nFe=0.05mol ∴mFe=0.05mol×56g/mol=2.8g (2)解:∵nH2= ∴反应生成的水中 ∴反应生成的水中n0= m0=0.04mol×16g/mol=0.64g ∴混合物的质量=2.8g+0.64g=3.44g ∴ωFe= 答:铁的质量是2.80克,铁的质量分数是81.4%. |

| A、0.30mol | B、0.28mol | C、0.25mol | D、0.22mol |
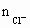 =0.1L×1mol/L=0.1mol ∴
=0.1L×1mol/L=0.1mol ∴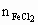 =0.05mol
=0.05mol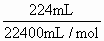 =0.01mol ∵盐酸中
=0.01mol ∵盐酸中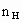 =0.1mol
=0.1mol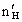 =0.1mol-0.01mol×2=0.08mol
=0.1mol-0.01mol×2=0.08mol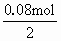 =0.04mol
=0.04mol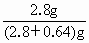 ×100%=81.4%
×100%=81.4%