题目内容
【题目】达喜【AlaMgb(OH)c(CO3)d ·xH2O】常用于中和胃酸。
(1)1 mol达喜与足量的盐酸完全反应后生成水的物质的量为 mol(用含x等字母的代数式表示)。
(2)达喜化学式中a、b、c、d的关系为a+b c+d(填“>”、“=”或“<”)。
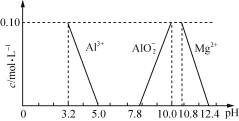
(3)已知在常温下溶液中Al3+、Mg2+、AlO2-的浓度与溶液pH的关系如上图所示。为测定达喜的组成,进行了下列实验:
① 取达喜6.02 g研碎,缓慢加入2.00 mol·L-1盐酸使其溶解,当加入盐酸85.00 mL时开始产生CO2,加入盐酸至90.00 mL时正好反应完全。
② 在①所得溶液中加入适量的 (填“氨水”、“氢氧化铝”或“氯化镁”)以调节溶液的pH至5.0~7.8,使有关离子完全沉淀。
③ 将②产生的全部沉淀过滤、洗涤,灼烧至恒重,称量为1.02 g。确定达喜的化学式为___________,并简要写出计算过程。
【答案】(1)(3a+2b+c+2x)/2或x+c+d(2分)
(2)<(1分)(3)氨水(1分)达喜的化学式为Al2Mg6(OH)16(CO3) ·4H2O
【解析】
试题分析:(1)设达喜的系数为1,根据质量守恒定律可得:1 AlaMgb(OH)c(CO3)d ·xH2O + (3a+2b)HCl = a AlCl3 + b MgCl2 + d CO2↑ + (3a+2b+c+2x)/2 H2O,由氧原子个数守恒可得:c+3d+x=2d+(3a+2b+c+2x)/2,解得:d=1.5a+b-0.5c或2d=3a+2b-c,则该反应生成的水为 (3a+2b+c+2x)/2或 (2d+2c+2x)/2mol=(c+d+x)mol;(2)达喜中铝、镁元素的化合价分别为+2、+3,OH-、CO32-的化合价分别为-1、-2,由化合价代数和为0可得:3a+2b-c-2d=0,转化为2(a+b)-2(c+d)=-(a+c)<0,则a+b<c+d;(3)②加入Al(OH)3或MgO时,最多只能将溶液pH调为7,要将溶液调成碱性,必须加碱,备选只有氨水满足;
③ 盐酸的总物质的量:2.00 mol·L-1×0.09 L=0.18 mol
产生CO2消耗盐酸的物质的量:(0.09-0.085)L×2.00 mol·L-1×2=0.02 mol
CO32-的物质的量:0.02 mol÷2=0.01 mol
6.02 g达喜中OH-的物质的量:0.18 mol-0.02 mol=0.16 mol
6.02 g达喜中Al3+的物质的量:![]() =0.02 mol
=0.02 mol
6.02 g达喜中Mg2+的物质的量:![]() =0.06 mol
=0.06 mol
6.02 g达喜中H2O的物质的量:
![]() =0.04 mol
=0.04 mol
n(Al3+)∶n(Mg2+)∶n(OH-)∶n(CO32-)∶n(H2O)
=0.02 mol∶0.06 mol∶0.16 mol∶0.01 mol∶0.04 mol=2∶6∶16∶1∶4
达喜的化学式为Al2Mg6(OH)16(CO3) ·4H2O
【考点地位】本题主要是考查了物质的组成的测定实验方案设计与探究。
【名师点晴】本题以达喜【AlaMgb(OH)c(CO3)d ·xH2O】的组成测定为载体,侧重考查了化学方程式的书写、元素守恒法、化合物中各元素化合价代数和规则、、根据信息书写化学方程式、根据化学方程式计算及实验方案的分析评价等知识。考查了学生对常见物质性质的掌握情况。考查了学生应用所学知识进行必要的分析,解决具体的化学问题的能力。化学实验实验为基础的科学,高考化学试题中对实验能力的考查赋分较高,今后复习备考多加关注。题目难度中等偏上。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案


