题目内容
下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)═CO2(g) ;△H1 C(s) +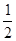 O2(g)═CO(g) ; △H2
O2(g)═CO(g) ; △H2
②S(s)+O2(g)═SO2(g) ;△H3 S(g) +O2(g)═SO2(g) ;△H4
③H2(g) +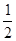 O2(g)═H2O(g);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(g);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8
| A.① | B.④ | C.①②③ | D.②③④ |
D
解析试题分析:①对于等量的同一物质完全燃烧放出的热量一定比不完全燃烧放出的热量要多。所以△H1<△H2
②同一物质在气态时含有的能量比液态或固态高,所以燃烧得到相同状态的产物放出的热量要多,△H3>△H4。③反应物状态相同得到液态产物比得到产物放热要多,所以△H5>△H6。④前者是吸热反应,后者是放热反应。所以△H7>△H8。选项为:D
考点:考查放热反应、吸热反应及物质的存在状态对反应热的影响的知识。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案化学反应中通常伴随着能量变化,下列说法中错误的是
| A.煤燃烧时将部分化学能转化为热能 |
| B.电解熔融Al2O3时将部分化学能转化为电能 |
| C.TNT爆炸时将部分化学能转化为动能 |
| D.镁条燃烧时将部分化学能转化为光能 |
根据以下三个热化学方程式:
(1)2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH= -Q1kJ·mol-1
(2)2H2S(g)+O2(g)=2S(g)+2H2O(g) ΔH= -Q2kJ·mol-1
(3)2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH= -Q3kJ·mol-1
判断 三者关系正确的是
三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
下列反应属于吸热反应的是
| A.碳与水蒸气制水煤气的反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝片与稀盐酸的反应 | B.Ba(OH)2?8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在氧气中的燃烧反应 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和固体硫分别完全燃烧,后者放出热量多 |
| B.由C(石墨)= C(金刚石) △H=+1.90 kJ/mol可知,金刚石比石墨稳定 |
| C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为: 2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ/mol |
| D.在稀溶液中,H+(aq)+ OH-(aq)=H2O(l) △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ |
已知下列四个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) △H1; 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2;
2H2S(g)+O2(g)=2S(s)+2H2O(g) △H3; 2H2S(g)+O2(g)=2S(s)+2H2O(l) △H4;
则△H四者的关系中正确的是
| A.△H1>△H2>△H3>△H4 | B.△H4>△H2>△H3>△H1 |
| C.△H3>△H4>△H1>△H2 | D.△H4>△H3>△H2>△H1 |