题目内容
已知98%的H2SO4的物质的量浓度为18.4 mol·L-1,试判断49%的H2SO4的物质的量浓度________9.2 mol·L-1(填“>”“<”或“=”)。
思路点拨:依据物质的量浓度定义或计算推理。设浓、稀溶液物质的量浓度和密度分别为c(浓)、c(稀)、ρ(浓)、ρ(稀)。设溶液质量为100 g,由cB=![]() ,得:
,得:
![]()
![]()
![]()
因ρ(稀)<ρ(浓),故![]()
即c(稀)<9.2 mol·L-1。
答案:<

练习册系列答案
相关题目
(16分)磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。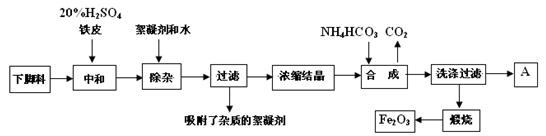

已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的H2SO4的配制500mL的20%的H2SO4,所需玻璃仪器是
| A.玻璃棒 | B.烧杯 | C.漏斗 | D.250mL容量瓶 |
(2)浓缩结晶后得到的晶体是 (填化学式),A中溶质是 ;
此溶液中各离子的浓度比较大小为: 。
(3)20%H2SO4和铁皮的作用分别是 。
(4)检验滤液中含有NH4+的方法是
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示):
。
 2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+
2SO3(g)△H=-2Q1 KJ/mol或SO2(g)+