题目内容
|
要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时,最佳顺序为 ①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液 | |
| [ ] | |
A. |
①③ |
B. |
③② |
C. |
③① |
D. |
①②③ |
答案:C
解析:
解析:
|
精析:证明有Fe2+的最佳方法不是直接证明Fe2+,而是将Fe2+转化为Fe3+,检验反应后产生的Fe3+,并能证明Fe3+在开始时没有,是反应产生的.加入NH4SCN如果没有明显现象则证明无Fe3+,再加Cl2水,如有Fe2+则可被氧化为Fe3+,会使NH4SCN变红色.KMnO4也能氧化Fe2+,但KMnO4本身为紫色,使Fe3+和NH4SCN显色不易观察. 小结:学习铁及其化合物的性质要抓住价态,从铁元素3种价态的相互转化去认识铁及其化合物间的氧化还原反应规律.要熟记Fe3+遇SCN-会生成红色物质的特性,并且要注意实验的可观察性. |

练习册系列答案
相关题目
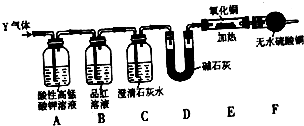
 某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.