题目内容
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应, 且氯水足量)。
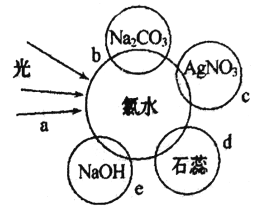
(1)能证明氯水具有漂白性的是_____________________(填“a”“b”“c”或“d”);
(2)c过程中的现象是_____________________________________;
(3)e过程中的离子方程式为____________________________________;
(4)实验室保存饱和氯水的方法是____________________________________。
【答案】 d 有白色沉淀生成 Cl2+2OH-== Cl-+ClO-+H2O 在阴凉处置于棕色试剂瓶中密封保存
【解析】Cl2+H2O![]() HCl+HClO是一个可逆反应,所以氯水中含有三种分子:H2O、Cl2、HClO及四种离子:H+、OH-、Cl-、ClO-
HCl+HClO是一个可逆反应,所以氯水中含有三种分子:H2O、Cl2、HClO及四种离子:H+、OH-、Cl-、ClO-
(1)氯水中含有的HClO有强氧化性,具有漂白性,能使紫色石蕊溶液褪色,所以证明氯水具有漂白性的是d
(2)氯水中含有的Cl-与Ag+反应生成白色沉淀,c过程中的现象是有白色沉淀生成
(3)e过程中发生Cl2与NaOH的反应,其离子方程式为Cl2+2OH-= Cl-+ClO-+H2O
(4)氯水中含有的HClO见光容易分解生成HCl和O2,从而导致氯水最后会全部变为盐酸,故必须盛放在棕色的细口瓶中并放置在阴凉处。答案为:在阴凉处置于棕色试剂瓶中密封保存

【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
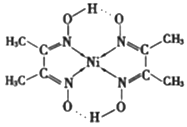
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
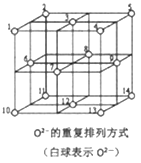
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。