题目内容
【题目】由合成气制备乙醇一般有两种方法:
(1)直接合成法①2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) △H1
CH3CH2OH(g) + 3H2O(g) △H1
②2CO(g) +4H2(g) ![]() CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1
(2)间接合成法
合成气反应生成二甲醚(CH3OCH3),二甲醚羰基化合生成乙酸甲酯,乙酸甲酯加氢得到乙醇。其生产流程如下图所示:
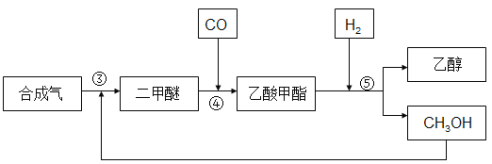
③ 3CO(g) + 3H2(g) ![]() CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
CH3OCH3(g) + CO2 △H3= -260.2kJ·mol-1
④ CH3OCH3(g) + CO(g) ![]() CH3COOCH3(g)
CH3COOCH3(g)
回答下列问题:
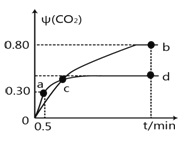
(1)在5MPa、起始投料量n(H2):n(CO2)=3:1时,测得不同温度时反应①中各物质的平衡组成如图1所示:
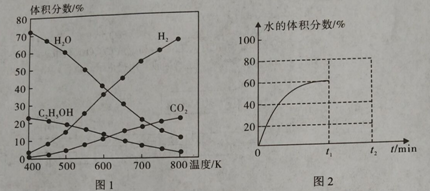
①反应①的△H1 0,△S 0。(填“>”、“<”或“=”)
②已知CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
CO2(g) + H2(g) △H= -41 kJ·mol-1,则△H1= 。
③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,请在图2中画出体系中水的体积分数在t1min后的变化曲线。
(2)对反应③处于化学平衡状态时的描述,正确的是 。(填字母)。
A.CO的含量保持不变 B.容器中CH3OCH3浓度与CO2浓度相等
C.3V正(CO)=V正(CH3OCH3) D.体系的温度保持不变
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是 。
(4)在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%。则氢气的反应速率v(H2)= ,平衡常数K= 。
【答案】(1)①<;<②-171.6kJ·mol-1
③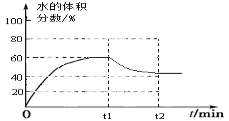 (达平衡时H2O%大于40%小于45%)
(达平衡时H2O%大于40%小于45%)
(2)AD
(3)由于甲醇分子间脱水可生成二甲醚,既实现了甲醇的回收利用,又增加了甲醚的含量,提高了目标产物的产率。(“实现甲醇的回收利用,提高原子利用率”等合理答案都给分,)
(4)1.5/t mol·L-1·min-1;9
【解析】
试题分析:①根据图示,升高温度,乙醇的含量减小,平衡逆向移动,正反应放热,△H1<0;正反应是气体物质的量减少的反应,所以△S<0;②2CO(g) +4H2(g) ![]() CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1;⑤CO(g) + H2O(g)
CH3CH2OH(g) +H2O(g) △H2= -253.6kJ·mol-1;⑤CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H= -41 kJ·mol-1;根据盖斯定律,②-⑤×2得:2CO2(g) + 6H2(g)
CO2(g) + H2(g) △H= -41 kJ·mol-1;根据盖斯定律,②-⑤×2得:2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) △H1=-171.6kJ·mol-1;③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,水的体积分数由60%降至达平衡时H2O%大于40%小于45%,
CH3CH2OH(g) + 3H2O(g) △H1=-171.6kJ·mol-1;③500K时,反应达到平衡后,在t1min时升温到600K,反应在t2min重新达到平衡,水的体积分数由60%降至达平衡时H2O%大于40%小于45%,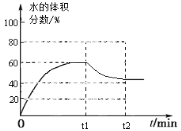 ;
;
(2)对反应③处于化学平衡状态时的描述,正确的是 。(填字母)。
A.根据定义,CO的含量保持不变,一定平衡;B容器中CH3OCH3浓度与CO2浓度相等,不一定平衡;
C.根据定义V正=V逆,达到平衡,3V正(CO)=V正(CH3OCH3) 不一定平衡 D.体系的温度保持不变,一定平衡;
(3)间接合成法中将甲醇(CH3OH)循环使用的目的是实现甲醇的回收利用,提高原子利用率。
(4)CH3COOCH3+2H2→CH3CH2OH+ CH3OH
开始 1 2 0 0
转化 0.75 1.5 0.75 0.75
平衡 0.25 0.5 0.75 0.75
在2Mpa、T℃时1L的恒容容器中,充入1.0mol乙酸甲酯和2.0mol氢气,发生反应⑤,经t min后反应达到平衡,测得乙酸甲酯的转化率为75%。则氢气的反应速率v(H2)=![]() 1.5/t mol·L-1·min-1,平衡常数K=
1.5/t mol·L-1·min-1,平衡常数K=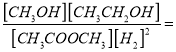 9。
9。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案