题目内容
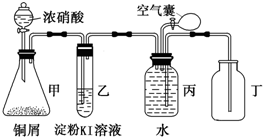 某校化学兴趣小组用所示装置图验证NO2的氧化性和NO的还原性.请回答下列问题:
某校化学兴趣小组用所示装置图验证NO2的氧化性和NO的还原性.请回答下列问题:(1)写出甲中反应的离子方程式:
(2)说明NO2具有氧化性的现象是
(3)说明NO具有还原性的操作和现象是
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由是
经小组讨论,他们设计了以下方案,其中合理的是
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中.
分析:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水;二氧化氮能氧化硫离子生成硫单质,一氧化氮和氧气反应生成红棕色气体二氧化氮;
(2)NO2具有氧化性,能将碘离子氧化为单质碘,碘单质遇到淀粉变蓝色;
(3)一氧化氮是无色气体,可以和氧气反应生成红棕色气体二氧化氮;
(4)二氧化氮和水反应生成硝酸,硝酸具有强氧化性;为防止硝酸的干扰,可以采用干燥的气体混合,根据其生成物判断二氧化氮是否具有氧化性.
(2)NO2具有氧化性,能将碘离子氧化为单质碘,碘单质遇到淀粉变蓝色;
(3)一氧化氮是无色气体,可以和氧气反应生成红棕色气体二氧化氮;
(4)二氧化氮和水反应生成硝酸,硝酸具有强氧化性;为防止硝酸的干扰,可以采用干燥的气体混合,根据其生成物判断二氧化氮是否具有氧化性.
解答:解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,离子反应方程式为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)NO2具有氧化性,能将碘离子氧化为单质碘,碘单质遇到淀粉变蓝色,所以乙试管中溶液变蓝色可以证明NO2具有氧化性,故答案为:乙试管中溶液变蓝色;
(3)二氧化氮和水反应生成的一氧化氮和氧气反应生成红棕色气体二氧化氮,说明NO具有还原性,所以看到的现象是:有红棕色气体生成,
故答案为:打开开关,挤压气囊,丙中气体由无色变为红色;
(4)二氧化氮和水反应生成硝酸,硝酸具有强氧化性,所以硝酸也能把硫离子氧化生成硫单质,对二氧化氮性质的检验造成干扰;为防止硝酸的干扰,故应在无水的环境中检验NO2的氧化性,将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性,
故答案为:挥发性出来的HNO3,NO2和水反应生成的HNO3是一种氧化性酸,也可将I-氧化成I2,使溶液变蓝;B.
(2)NO2具有氧化性,能将碘离子氧化为单质碘,碘单质遇到淀粉变蓝色,所以乙试管中溶液变蓝色可以证明NO2具有氧化性,故答案为:乙试管中溶液变蓝色;
(3)二氧化氮和水反应生成的一氧化氮和氧气反应生成红棕色气体二氧化氮,说明NO具有还原性,所以看到的现象是:有红棕色气体生成,
故答案为:打开开关,挤压气囊,丙中气体由无色变为红色;
(4)二氧化氮和水反应生成硝酸,硝酸具有强氧化性,所以硝酸也能把硫离子氧化生成硫单质,对二氧化氮性质的检验造成干扰;为防止硝酸的干扰,故应在无水的环境中检验NO2的氧化性,将干燥的NO2与干燥的H2S气体混合,若有淡黄色固体生成,即可证明NO2的氧化性,
故答案为:挥发性出来的HNO3,NO2和水反应生成的HNO3是一种氧化性酸,也可将I-氧化成I2,使溶液变蓝;B.
点评:本题利用Cu与浓HNO3的反应制取NO2,再利用NO2与水的反应制NO,明确物质的性质是解本题关键,知道二氧化氮和一氧化氮性质的区别,难度中等.

练习册系列答案
相关题目
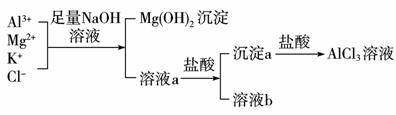
( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是 。
?(2)?该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物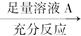 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是 ?(填代号)
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
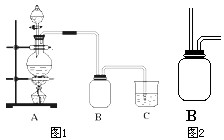 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图1所示:
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图1所示: