题目内容
【题目】下列物质各1 mol,质量最大的是
A. H2 B. O2 C. H2O D. CO2
【答案】D
【解析】
根据m=nM可知,物质的量相等情况下,摩尔质量越大,则物质的质量越大。
根据m=nM可知,物质的量相等情况下,摩尔质量越大,则物质的质量越大,H2的摩尔质量为2g/mol,O2的摩尔质量为32g/mol,H2O的摩尔质量为18g/mol,CO2的摩尔质量为44g/mol,摩尔质量:CO2>O2>H2O>H2,故二氧化碳的质量最大,答案选D。

 考前必练系列答案
考前必练系列答案【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________________。
(2)H2O2分解的化学方程式为________________________。
(3)实验①和②的目的是_______________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
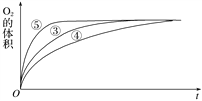
分析上图能够得出的实验结论是_______________________________________________。