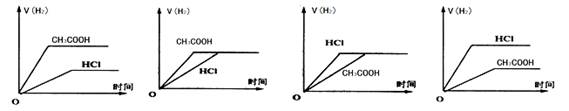
题目内容
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
| A.溶液的pH相同 |
| B.分别加入足量锌片,盐酸生成的H2体积大 |
| C.分别稀释100倍后,醋酸浓度与盐酸浓度相等 |
| D.由水电离出的氢离子浓度均为1×10-12 mol·L-1 |
C
试题分析:A、盐酸是强酸,醋酸是弱酸存在电离平衡,因此在物质的量浓度相同的条件下醋酸溶液的pH大,A不正确;B、不能确定酸溶液的体积,因此不能计算产生氢气的体积,B不正确;C、醋酸和盐酸在物质的量浓度相同的条件下稀释相同的倍数后溶液的浓度仍然相等,C正确;D、盐酸溶液中氢离子浓度大于醋酸溶液中氢离子浓度,所以盐酸溶液中对水的电离抑制程度大,其中盐酸溶液中由水电离出的氢离子浓度为1×10-12 mol·L-1,而醋酸溶液中由水电离出的氢离子浓度大于1×10-12 mol·L-1,D不正确,答案选C。

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:



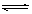 H++HS-,HS-
H++HS-,HS-