题目内容
【题目】钢铁是目前用量最大、用途最广的金属材料,但钢铁容易生锈. 
(1)某同学取一颗光亮的铁钉按图甲装置实验.数天后,试管内可观察到的现象是(填字母代号).
A.铁钉不生锈,液面上升
B.铁钉生锈,液面上升
C.铁钉生锈,液面下升
(2)铁表面镀锌可以增强铁的耐腐蚀性.铁片镀锌的装置图如乙,其中铁片作极(填“阳”或“阴”),锌片上的电极反应式是 .
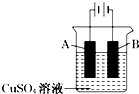
(3)如图丙在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.片刻后可观察到的现象是(指悬吊的金属圈)(填字母代号);
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
【答案】
(1)B
(2)阴;Zn﹣2e﹣=Zn2+
(3)D
【解析】解:(1)中性条件下,铁钉发生吸氧腐蚀,所以铁钉生锈,氧气和铁转化为氢氧化铁,导致试管内气体压强减小,则试管内液面上升,故选B;(2)铁片镀锌,则铁作阴极、锌作阳极,锌片上锌失电子生成锌离子进入溶液,电极反应式为Zn﹣2e﹣=Zn2+ , 所以答案是:阴;Zn﹣2e﹣=Zn2+;(3)铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,负极上铁失电子生成亚铁离子进入溶液,所以铁圈质量减少;银圈上铜离子得电子生成铜单质附着在银圈上,导致银圈质量增加,所以观察到的现象是:银圈向下倾斜,故选D.
【考点精析】解答此题的关键在于理解金属的电化学腐蚀与防护的相关知识,掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目