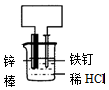
题目内容
2. 如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.(1)A中反应的离子方程式是Fe+2H+=Fe2++H2↑.
(2)B中Cu极属于原电池中的正极;Fe极附近溶液呈浅绿色.
(3)C中被腐蚀的金属是Zn(填化学式),A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C(用“>”表示).
分析 (1)铁与氢离子反应产生亚铁离子和氢气;
(2)B形成原电池,铁比铜活泼,铁失电子作负极,铜作正极;
(3)C形成原电池,锌比铁活泼,锌作负极被氧化;电化学腐蚀的速率大于化学腐蚀的速率,原电池中正极金属被保护.
解答 解:(1)铁与氢离子反应产生亚铁离子和氢气,离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(2)B形成铁、铜稀硫酸原电池,铁比铜活泼,铜作正极,活泼金属铁失电子产生亚铁离子,则铁附近溶液呈浅绿色,故答案为:正;浅绿;
(3)C形成锌、铁稀硫酸原电池,锌比铁活泼,锌失电子被腐蚀;A发生化学腐蚀,B发生电化学腐蚀,C中锌比铁活泼,铁做原电池的正极而被保护,则A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C,故答案为:Zn;B>A>C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
19.化学与社会、生活密切相关,下列说法不正确的是( )
| A. | 氯化铁溶液常用于腐蚀铜制印刷电路板 | |
| B. | 钢铁锈蚀后可以避免再锈蚀 | |
| C. | 明矾可用于净水 | |
| D. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
16.在不同条件下分别测得反应2A+B?3C的化学反应速率,其中表示该反应进行得最快的是( )
| A. | v(A)=0.4mol/(L•s) | B. | v(B)=0.1mol/(L•s) | C. | v(C)=0.3mol/(L•s) | D. | v(A)=0.3mol/(L•s) |
3.下列说法正确的是( )
| A. | N、O、F最高正价依次升高 | |
| B. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | Al3+、Na+、O2-微粒半径依次增大 |
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯所含的碳碳双键数为3NA | |
| B. | 常温常压下,28 g乙烯和丙烯(C3H6)的混合气体中所含氢原子数为4NA | |
| C. | 1 mol金属钠在足量乙醇完全反应转移的电子数为2NA | |
| D. | 1 mol•L-1的醋酸溶液中含醋酸分子数为NA |
14.下列各组混合物中,不能用分液漏斗进行分离的是( )
| A. | 水和溴苯 | B. | 乙酸乙酯和饱和碳酸钠溶液 | ||
| C. | 碘和四氯化碳 | D. | 硝基苯和水 |
11.下列关于化学反应速率的说法正确的是( )
| A. | 对任何化学反应来说,反应速率越大,反应现象就越明显 | |
| B. | 化学反应速率为“0.8mol•L-1•s-1”所表示的意义是:时间为1s时,某物质的浓度为0.8mol•L-1 | |
| C. | 可逆反应达到化学平衡状态时,当正反应速率增大时,逆反应速率会减小 | |
| D. | 对于放热反应,提高反应温度也能增大反应速率 |