题目内容
如下图所示,将等物质的量的Cl2和CH4充入一容积为25 mL的量筒,并将量筒倒置在盛有饱和食盐水的水槽中,用日光散射,可观察到的现象是:
(1)__________________。(2)__________________。
(3)__________________。(4)__________________。
思路点拨:甲烷与氯气虽为等物质的量混合,但却不是只发生一元取代:
CH4+Cl2![]() CH3Cl+HCl
CH3Cl+HCl
CH3Cl+Cl2![]() CH2Cl2+HCl
CH2Cl2+HCl
CH2Cl2+Cl2![]() CHCl3+HCl
CHCl3+HCl
CHCl3+Cl2![]() CCl4+HCl
CCl4+HCl
随着反应的进行,氯气逐渐减少,黄绿色气体颜色逐渐变浅,最后气体变为无色;生成物有无色油状液体CH2Cl2、CHCl3和CCl4,因氯气溶解其中而呈黄色,黄色液滴附着在试管内壁上;生成物有无色气体HCl和CH3Cl,HCl易溶于水,溶液中Cl-浓度超饱和,饱和食盐水中析出NaCl晶体;最后试管中只剩余气体CH3Cl,由反应方程式可以看出其体积必小于原来混合气体的体积,故量筒内液面升高。
答案:(1)黄绿色气体逐渐变浅,最后变为无色 (2)油状液滴附着在试管内壁上 (3)饱和食盐水中析出NaCl晶体 (4)量筒内混合气体的体积减小,量筒内液面升高

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
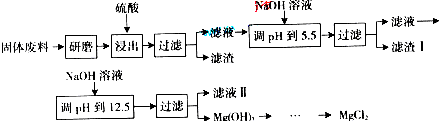
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用浓NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。下列有关该方法的叙述中不正确的是
| A.能量消耗大是该方法的一大缺点 |
| B.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| C.整个过程中,有2种物质可以循环利用 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |