题目内容
【题目】387℃时,在甲、乙两个体积均为1.0L的恒容密闭容器中发生甲醇合成二甲醚的反应:2CH3OH(g)![]() CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
CH3OCH3(g) + H2O(g),起始时、平衡时各物质的物质的量如下表所示。
容器 | 起始物质的量/mol | 平衡物质的量/mol | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | |
甲 | 0.20 | 0.080 | 0.080 |
乙 | 0.40 | a | a |
则:(1)表中a=________。
(2)若起始时向甲容器中充入0.20mol CH3OH(g)、0.50mol CH3OCH3和0.10molH2O(g),则反应达平衡时容器中CH3OH(g)的浓度为多少?_______(写出解题过程)
【答案】0.16 0.133mol/L
【解析】
(1)根据反应方程式,反应前后气体系数之和相等,因此有0.2:0.08=0.4:a,a=0.16;
(2)由表中的甲容器数据可得:387℃时反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g), 的平衡常数
CH3OCH3(g) + H2O(g), 的平衡常数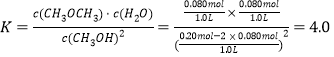
若起始时甲容器中充入0.20molCH3OH(g)、0.50mol CH3OCH3(g)、 0.10molH2O(g),  , 反应向正反应方向进行,v(正) >v(逆) ,设达平衡时新生成的CH3OCH3(g)物质的量浓度为x
, 反应向正反应方向进行,v(正) >v(逆) ,设达平衡时新生成的CH3OCH3(g)物质的量浓度为x
2CH3OH(g)![]() CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
起始浓度(mol/L) 0.20 0.50 0.10
转化浓度(mol/L) 2x x x
平衡浓度(mol/L) 0.20-2x 0.50+x 0.10+x
![]()
![]()
![]()
解得:x=0.22mol/L(不合理,舍去) x=1/30mol/L
平衡时CH3OH(g)物质的量浓度为(0.20mol/L-2×1/30mol/L)=0.133mol/L.

 阅读快车系列答案
阅读快车系列答案【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
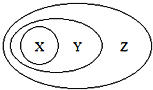
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H,上述反应分两步完成,如图所示。
2NO2(g) △H,上述反应分两步完成,如图所示。

回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数![]() 、
、![]() 的数学关系是K=___________。若将容器的温度改变为T2时其
的数学关系是K=___________。若将容器的温度改变为T2时其![]() =
=![]() ,则T1__________T2 (填“>”、“<”或“=”)。
,则T1__________T2 (填“>”、“<”或“=”)。
(4)水能部分吸收NO、NO2混合气体得到HNO2溶液。向20 mL 0.10 mol/LHNO2溶液中逐滴加入0.10 mol·L-1 NaOH溶液,所得pH曲线如图所示。则A点对应的溶液中![]() =_______。
=_______。