题目内容
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
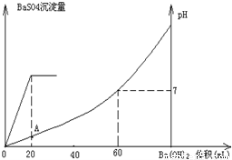
A.图中A点溶液的pH=1
B.生成沉淀的最大质量为2.33g
C.原混合溶液中盐酸物质的量浓度为0.1mol/L
D.当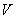 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO
[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO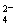 ═BaSO4↓
═BaSO4↓
A
【解析】
试题分析:由图可知,0~20mLBa(OH)2溶液发生H2SO4+Ba(OH)2═BaSO4↓+2H2O,发生的离子方程式是2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,D错;20mL~60mLBa(OH)2溶液发生发生H++OH-═H2O,由图可知,加入20mLBa(OH)2溶液时,硫酸钡沉淀达最大值,设硫酸的物质的量为x,则:
H2SO4???????????? +????????? Ba(OH)2???????????  ?????? BaSO4↓? +???? H2O
?????? BaSO4↓? +???? H2O
1????? ??????????????? ? 1????? ?????????????????? 233g
x?????? ????????? 0.02L×0.05mol·L-1???????????????????????? y
故x=0.02L×0.05mol·L-1=0.001mol,y=0.233g,
硫酸的物质的量浓度为 =0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
=0.05mol·L-1,生成硫酸钡沉淀的最大质量为0.233g,B错;
由图可知,PH=7时,消耗60mLBa(OH)2溶液,由H++OH-═H2O可知原溶液中含有的n(H+)=n(OH-)=0.06L×0.05mol·L-1=0.003mol,故n(HCl)=0.003mol×2-0.001mol×2=0.004mol,
故原溶液中HCl的物质的量浓度= =0.2mol·L-1,C错;
=0.2mol·L-1,C错;
由图可知,A点硫酸完全反应,氢离子的浓度为 =0.1mol·L-1,则pH=-lg0.1=1,A对;
=0.1mol·L-1,则pH=-lg0.1=1,A对;
综上所述,所以选A。
考点:考查混合物的计算。

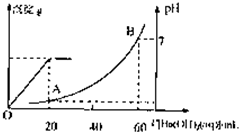 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点溶液的pH=1 | B、生成沉淀的最大质量为2.33g | C、原混合溶液中盐酸物质的量浓度为0.1mol/L | D、当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| A、相同物质的量浓度的醋酸溶液和氢氧化钠溶液等体积混合 | B、相同物质的量浓度的盐酸和氨水等体积混合 | C、pH=3的硫酸溶液和pH=11的氨水等体积混合 | D、pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 |